Wärme der Verdampfung
Einführung
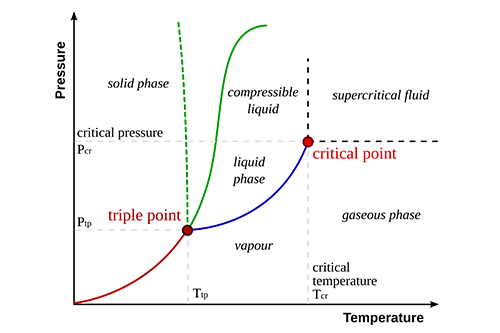
Die Verdampfungswärme ist ein grundlegendes Konzept in der Thermodynamik und spielt bei verschiedenen natürlichen und industriellen Prozessen eine entscheidende Rolle. Sie gibt die Energiemenge an, die erforderlich ist, um einen Stoff von seiner flüssigen in seine gasförmige Phase zu überführen, ohne dass sich seine Temperatur ändert. Das Verständnis dieser Eigenschaft ist für Anwendungen von der Klimawissenschaft bis hin zu technischen Systemen unerlässlich.
Formulierung
Die Verdampfungswärme (ΔHvap) kann als die Energie verstanden werden, die erforderlich ist, um die intermolekularen Kräfte zu überwinden, die die Flüssigkeit zusammenhalten. Im Gegensatz zur spezifischen Wärmekapazität, die sich mit Temperaturänderungen befasst, bezieht sich die Verdampfungswärme speziell auf den Phasenübergang. Diese Energie wird normalerweise in Joule pro Gramm (J/g) oder Kilojoule pro Mol (kJ/mol) gemessen.
Wasser und seine Verdampfungswärme
Wasser hat im Vergleich zu vielen anderen Stoffen eine hohe Verdampfungswärme, was sich sowohl auf die Umwelt als auch auf biologische Systeme auswirkt. Diese Eigenschaft ermöglicht es dem Wasser, die Temperatur durch Prozesse wie Schwitzen und Transpiration in Pflanzen wirksam zu regulieren. Außerdem trägt die hohe Verdampfungswärme von Wasser zu seiner Rolle bei Wetterphänomenen und der Klimaregulierung bei.
Beispiele für Verdunstungswärme
Die Verdampfungswärme variiert stark zwischen den verschiedenen Substanzen. Zum Beispiel:
- Ethanol: Geringere ΔHvap im Vergleich zu Wasser, wodurch es leichter zu verdampfen ist.
- Quecksilber: Extrem hohe ΔHvap, erfordert erhebliche Energie für die Umwandlung in Gas.
- Aceton: Mäßiger ΔHvap, wird aufgrund seiner Flüchtigkeit in verschiedenen industriellen Anwendungen eingesetzt.
Das Verständnis dieser Unterschiede ist entscheidend für die Auswahl geeigneter Materialien und Bedingungen in der chemischen Technik und anderen wissenschaftlichen Bereichen.
Tabelle der Verdampfungswärme
|
Substanz |
Verdampfungswärme (kJ/mol) |
Häufige Verwendungen |
|
Wasser |
40.7 |
Klimaregulierung, biologische Prozesse |
|
Ethanol |
38.6 |
Lösungsmittel, Kraftstoff, Getränke |
|
Quecksilber |
59.1 |
Thermometer, elektrische Anwendungen |
|
Aceton |
31.3 |
Lösungsmittel, Nagellackentferner |
|
Benzol |
30.8 |
Chemische Herstellung, Lösungsmittel |
Weitere Informationen finden Sie unter Stanford Advanced Materials (SAM).
Häufig gestellte Fragen
Was ist die Verdampfungswärme?
Die Verdampfungswärme ist die Energie, die erforderlich ist, um eine Substanz bei konstanter Temperatur und konstantem Druck von einer Flüssigkeit in ein Gas zu verwandeln.
Warum ist die Verdampfungswärme von Wasser wichtig?
Die hohe Verdampfungswärme von Wasser hilft bei der Temperaturregulierung in natürlichen und biologischen Systemen durch Prozesse wie Schwitzen und Transpiration.
Wie unterscheidet sich die Verdampfungswärme von Stoffen?
Die Verdampfungswärme verschiedener Stoffe hängt von der Stärke ihrer zwischenmolekularen Kräfte ab und beeinflusst, wie viel Energie für die Verdampfung benötigt wird.
Kann die Verdampfungswärme experimentell gemessen werden?
Ja, sie kann mit Hilfe der Kalorimetrie gemessen werden, bei der die während der Verdampfung absorbierte Energie quantifiziert wird.
Wie wird die Verdampfungswärme in der Industrie eingesetzt?
Sie wird bei der Planung von Kühlsystemen und Destillationsprozessen sowie zur Ermittlung des Energiebedarfs für Phasenwechsel in verschiedenen Anwendungen verwendet.