Phasendiagramme: Typen und Beispiele
Einführung in Phasendiagramme
Phasendiagramme sind wichtige Hilfsmittel in der Chemie und der Materialwissenschaft. Sie stellen die physikalischen Zustände einer Substanz unter verschiedenen Temperatur- und Druckbedingungen grafisch dar. Diese Diagramme helfen Wissenschaftlern und Ingenieuren bei der Vorhersage des Verhaltens von Materialien bei Prozessen wie Erhitzung, Abkühlung und Kompression.
Die Zustände der Materie
Das Verständnis der drei Hauptzustände der Materie - fest, flüssig und gasförmig - ist für die Interpretation von Phasendiagrammen von grundlegender Bedeutung.
Festkörper
Im festen Zustand sind die Moleküle in einer festen Struktur dicht gepackt, was zu einer bestimmten Form und einem bestimmten Volumen führt. Im Vergleich zu Flüssigkeiten und Gasen haben Feststoffe eine hohe Dichte und eine geringe Entropie.
Flüssigkeit
Flüssigkeiten haben ein bestimmtes Volumen, nehmen aber die Form ihres Behälters an. Die Moleküle in einer Flüssigkeit sind weniger dicht gepackt als in einem Feststoff, was zu Fließfähigkeit und höherer Entropie führt.
Gase
Gase haben weder eine bestimmte Form noch ein bestimmtes Volumen. Die Moleküle sind weit voneinander entfernt und bewegen sich frei, was zu der höchsten Entropie unter den drei Zuständen führt.
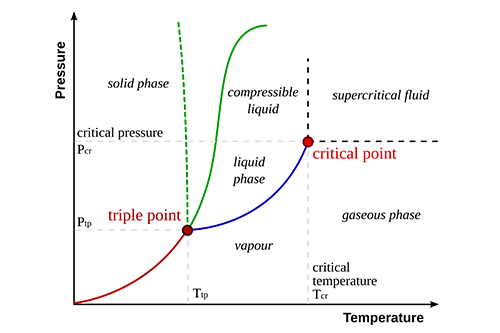
Hauptmerkmale von Phasendiagrammen
Phasendiagramme enthalten in der Regel mehrere Hauptmerkmale:
- Tripelpunkt: Die einzigartige Reihe von Bedingungen, bei denen feste, flüssige und gasförmige Phasen im Gleichgewicht koexistieren.
- Kritischer Punkt: Die Temperatur und der Druck, über die hinaus ein Gas nicht verflüssigt werden kann.
- Phasengrenzen: Linien, die verschiedene Phasen voneinander trennen und die Bedingungen angeben, unter denen sich eine Phase in eine andere umwandelt.
Die Bedeutung von Phasendiagrammen
Phasendiagramme sind für verschiedene Anwendungen von entscheidender Bedeutung, darunter:
- Materialwissenschaft: Entwicklung von Materialien mit spezifischen Eigenschaften durch Steuerung ihrer Phase während der Verarbeitung.
- Meteorologie:Verständnis der atmosphärischen Bedingungen und Wettermuster.
- Chemische Technik: Optimierung von Reaktionen und Trennungen durch Steuerung von Temperatur und Druck.
Phasendiagramm-Tabelle
|
Phase Region |
Merkmale |
Beispiel Bedingungen |
|
Feststoff |
Feste Form und Volumen, geringe Entropie |
Eis bei 0°C und 1 atm |
|
Flüssig |
Bestimmtes Volumen, die Form passt sich dem Behälter an |
Wasser bei 25°C und 1 atm |
|
Gas |
Keine feste Form oder Volumen, hohe Entropie |
Wasserdampf bei 100°C und 1 atm |
|
Tripelpunkt |
Alle drei Phasen koexistieren |
0,01°C und 0,006 atm für Wasser |
|
Kritischer Punkt |
Jenseits dieses Punktes sind die flüssige und die gasförmige Phase nicht mehr voneinander zu unterscheiden |
374°C und 218 atm für Wasser |
Weitere Informationen finden Sie unterStanford Advanced Materials (SAM).
Häufig gestellte Fragen
Welche Informationen kann ich aus einem Phasendiagramm gewinnen?
Ein Phasendiagramm zeigt die Stabilität der verschiedenen Phasen (fest, flüssig, gasförmig) bei verschiedenen Temperaturen und Drücken und hilft bei der Vorhersage des Materialverhaltens.
Welche Bedeutung hat der Tripelpunkt in Phasendiagrammen?
Der Tripelpunkt ist der Punkt, an dem sich feste, flüssige und gasförmige Phasen im Gleichgewicht befinden, was einzigartige Bedingungen für die Untersuchung von Phasenübergängen bietet.
Was geschieht am kritischen Punkt in einem Phasendiagramm?
Am kritischen Punkt verschwindet die Unterscheidung zwischen flüssiger und gasförmiger Phase, was zu einer überkritischen Flüssigkeit mit einzigartigen Eigenschaften führt.
Können Phasendiagramme für Gemische oder nur für reine Stoffe verwendet werden?
Phasendiagramme können sowohl für Reinstoffe als auch für Gemische erstellt werden, wobei die Diagramme für Gemische aufgrund zusätzlicher Variablen komplexer sind.
Inwiefern sind Phasendiagramme für industrielle Anwendungen nützlich?
Sie helfen bei der Planung von Prozessen wie Kristallisation, Destillation und Materialsynthese, indem sie die Phasenänderungen unter verschiedenen Bedingungen vorhersagen.