Katalysatorvergiftungen bei Edelmetallkatalysatoren verstehen: Ursachen, Probleme und Lösungen
1 Einleitung
Edelmetallkatalysatoren spielen eine wichtige Rolle in der chemischen Industrie, im Energiesektor und im Umweltschutz. Aufgrund ihrer einzigartigen elektronischen Struktur und Oberflächeneigenschaften können Edelmetallkatalysatoren verschiedene chemische Reaktionen effizient katalysieren. In der Praxis werden diese Katalysatoren jedoch häufig durch Schadstoffe beeinträchtigt, was zu einer verminderten Aktivität, einer veränderten Selektivität und sogar einer kürzeren Lebensdauer führt. Um dieser Herausforderung zu begegnen, werden in diesem Blog die Mechanismen und Anwendungen von Edelmetallkatalysatoren im Detail erörtert, die Ursachen und Auswirkungen von Katalysatorvergiftungen untersucht und Maßnahmen zur Verbesserung der Vergiftungsresistenz und Lebensdauer vorgeschlagen.

Abb. 1 Schwarzes Platinpulver (Brennstoffzellenqualität), bereitgestellt von Stanford Advanced Materials
2 Einführung in Edelmetallkatalysatoren
2.1 Mechanismen von Edelmetallkatalysatoren
Was die elektronische Struktur betrifft, so haben Edelmetalle (z. B. Platin, Palladium, Rhodium, Iridium usw.) gefüllte oder nahezu gefüllte d-Elektronen-Orbitale. Diese d-Elektronenorbitale können sich effektiv mit den Orbitalen der Reaktionsmoleküle überlappen und liefern so die notwendige Aktivierungsenergie, so dass die Reaktion mit einer niedrigeren Energiebarriere durchgeführt werden kann. Die Beteiligung von d-Elektronen ermöglicht es den Edelmetallen, mit einer Vielzahl von Reaktionspartnern (z. B. Wasserstoff, Sauerstoff, Kohlenwasserstoffe usw.) Zwischenprodukte zu bilden und den Reaktionsprozess zu erleichtern. Die hohe Elektronendichte und die gleichmäßige Verteilung der Edelmetallatome führen zu einer hohen Elektronenwolkendichte auf ihren Oberflächen. Dies trägt dazu bei, dass der Edelmetallkatalysator bei der Reaktion Elektronen abgeben oder aufnehmen kann, wobei er die Rolle eines guten Elektronendonators oder -akzeptors spielt und die Reaktion fördert.
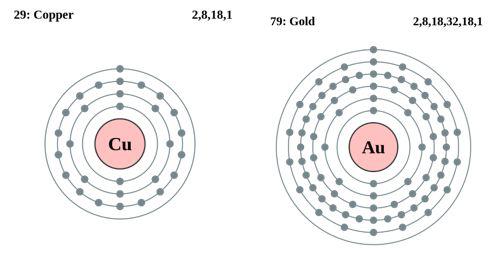
Abb. 2 Periphere Elektronenanordnungen von Kupfer- und Goldatomen
Was die Oberflächeneigenschaften betrifft, so verfügt die Oberfläche des Edelmetalls über eine starke Adsorptionskapazität, die die Reaktionsmoleküle wirksam adsorbieren kann. Diese Adsorptionsfähigkeit ist hauptsächlich auf die starke Wechselwirkung zwischen Edelmetallatomen und die hohe Aktivität der Oberflächenatome zurückzuführen. Edelmetallkatalysatoren können sowohl durch physikalische als auch durch chemische Adsorption mit den Reaktionsmolekülen interagieren und so aktive Stellen zur Förderung der Reaktion bereitstellen. Die Oberflächen von Edelmetallkatalysatoren haben auch eine gute Rekonstruktionsfähigkeit. Während des Reaktionsprozesses kann die Oberfläche der Edelmetallatome bis zu einem gewissen Grad umgebaut werden, um sich an die Adsorption und Reaktion verschiedener Reaktantenmoleküle anzupassen. Diese Fähigkeit zur Umgestaltung der Oberfläche trägt dazu bei, dass der Katalysator unter verschiedenen Reaktionsbedingungen eine effiziente katalytische Aktivität beibehält.
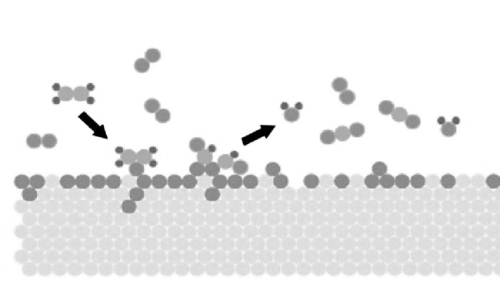
Abb. 3 Schematisches Diagramm der Reaktion von Gasmolekülen, die an der Oberfläche von Edelmetallen adsorbiert werden
Darüber hinaus weisen Edelmetalle eine hohe thermodynamische Stabilität auf und können ihre Struktur und katalytische Aktivität bei hohen Temperaturen und in rauen chemischen Umgebungen beibehalten. Dadurch weisen Edelmetallkatalysatoren eine ausgezeichnete Haltbarkeit und Stabilität bei einer Vielzahl industrieller Reaktionen auf (z. B. Hochtemperatur-Cracking, Oxidationsreaktionen usw.).
Edelmetallkatalysatoren sind in der Lage, viele Arten von Reaktionen zu katalysieren, einschließlich Hydrierung, Oxidation, Disproportionierung, Kopplung usw. Diese Vielseitigkeit ist vor allem auf ihre zahlreichen oberflächenaktiven Stellen und ihre flexiblen elektronischen Strukturen zurückzuführen, die es den Edelmetallen ermöglichen, sich an unterschiedliche Reaktionsmechanismen und -bedingungen anzupassen. Verschiedene Arten von Edelmetallen können auch Legierungen mit anderen Metallen bilden, um ihre elektronischen Strukturen und Oberflächeneigenschaften weiter zu regulieren. Katalysatoren aus Platin-Palladium-Legierungen weisen beispielsweise bei bestimmten Reaktionen eine höhere katalytische Leistung auf als Katalysatoren aus Einzelmetallen. Legierungen können die Aktivität, Selektivität und Stabilität von Edelmetallkatalysatoren optimieren und so ihre Gesamtleistung verbessern.
2.2 Anwendungen von Edelmetallkatalysatoren
Edelmetallkatalysatoren werden aufgrund ihrer katalytischen Wirkung auf Gasreaktionen in der Gasaufbereitung zum Schutz der Umwelt eingesetzt. Die ternären Katalysatoren, die üblicherweise bei der Behandlung von Autoabgasen eingesetzt werden, verwenden Platin (Pt), Palladium (Pd) und Rhodium (Rh) als Hauptbestandteile zur Umwandlung von Kohlenmonoxid (CO), Stickoxiden (NOx) und unverbrannten Kohlenwasserstoffen (HC) im Autoabgas in harmloses Kohlendioxid (CO2), Stickstoff (N2) und Wasser (H2O). Platin und Palladium werden auch in Dieselabgasbehandlungssystemen verwendet, um Rußpartikel und Stickoxide zu oxidieren, die von Dieselmotoren ausgestoßen werden. Bei der Abgasbehandlung in chemischen Industrieanlagen und Raffinerien werden ebenfalls Edelmetallkatalysatoren wie Platin und Palladium eingesetzt, die schädliche Bestandteile wirksam aus dem Abgas entfernen können. Chemische Sensoren, die auf Edelmetallkatalysatoren basieren, werden zum Nachweis von gasförmigen Schadstoffen, toxischen Gasen und Biomolekülen in der Umwelt verwendet, z. B. Wasserstoffsensoren und Formaldehydsensoren. Edelmetallkatalysatoren werden auch für den Schadstoffabbau eingesetzt, z. B. für den photokatalytischen Abbau organischer Schadstoffe bei der Wasseraufbereitung und für Verbundkatalysatoren aus Platin- und Titanoxiden bei der photokatalytischen Hydrolyse von Wasser zur Wasserstofferzeugung.
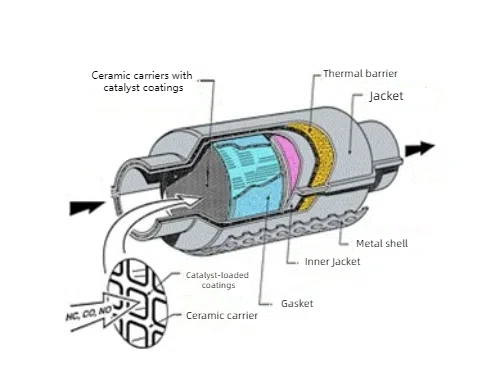
Abb. 4 Struktur des Drei-Wege-Katalysators
Im Energiebereich werden Edelmetallkatalysatoren, insbesondere Platinkatalysatoren, im elektrochemischen Prozess der Wasserelektrolyse und der Oxidation von Methanol in Brennstoffzellen eingesetzt, um die Effizienz der elektrischen Energieumwandlung zu erhöhen. Platin-Katalysatoren in Proton Exchange Membrane Fuel Cells (PEMFC) fördern die elektrochemische Reaktion zwischen Wasserstoff und Sauerstoff an den Elektroden, um Strom und Wasser zu erzeugen. Katalysatoren aus einer Platin-Ruthenium-Legierung werden in Direktmethanol-Brennstoffzellen (DMFC) zur Oxidation von Methanol und zur Verbesserung des Wirkungsgrads der Brennstoffzelle eingesetzt. Platin-Elektroden können auch zur Elektrolyse von Wasser zur Erzeugung von Wasserstoff verwendet werden, was die Effizienz der Reaktion verbessert. Edelmetallkatalysatoren werden auch bei der Umwandlung von Biomasse in hochwertige Chemikalien und Kraftstoffe eingesetzt, z. B. bei der Hydrodeoxygenierungsreaktion in der Biodieselproduktion.
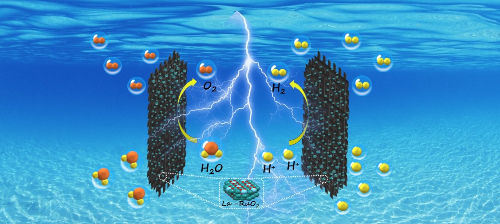
Abb. 5 Wasserstoffproduktion aus saurem Elektrolytwasser, katalysiert durch La-RuO2 [5]
In der chemischen Produktion werden Edelmetallkatalysatoren häufig für organische Anwendungen eingesetzt. In der Erdölraffinerie können sowohl Platin- als auch Palladiumkatalysatoren im Hydrodesulfurierungsverfahren zur Entfernung von Sulfiden aus Rohöl eingesetzt werden, wodurch die Kraftstoffqualität verbessert werden kann. Bei der Ölreformierung helfen Platinkatalysatoren auch bei der Herstellung von hochoktanigem Benzin und aromatischen Verbindungen. In der organischen Syntheseindustrie werden Platin- und Palladiumkatalysatoren häufig als Katalysatoren für Hydrierungsreaktionen eingesetzt, wodurch sich die Effizienz der Hydrierung von Doppel- und Dreifachbindungen verschiedener organischer Verbindungen erheblich verbessert. Palladiumkatalysatoren können auch die Suzuki-Kupplungsreaktion und die Heck-Reaktion katalysieren, die eine wichtige Rolle bei der Arzneimittelsynthese und dem Aufbau komplexer organischer Moleküle spielen. Im Bereich der Arzneimittelsynthese werden Edelmetallkatalysatoren häufig für chemische Umwandlungen in Schlüsselschritten eingesetzt, z. B. für Palladium-katalysierte Kreuzkupplungsreaktionen, die bei der Synthese komplexer Arzneimittelmoleküle eine unersetzliche Rolle spielen. Platin- und Palladiumkatalysatoren werden auch häufig in der chiralen Katalyse eingesetzt und katalysieren asymmetrische Hydrierungsreaktionen zur Herstellung chiraler Arzneimittelzwischenprodukte, die die optische Reinheit und biologische Aktivität der Arzneimittel gewährleisten. Edelmetallkatalysatoren haben wichtige Anwendungen bei der Herstellung von Nanomaterialien, z. B. die Verwendung von Platin- und Goldkatalysatoren zur Herstellung von Hochleistungs-Nanomaterialien für elektronische und optoelektronische Geräte.
3 Katalysator-Vergiftung
3.1 Definition von Katalysatorvergiftungen
Unter Katalysatorvergiftung versteht man den Verlust oder die erhebliche Verringerung der katalytischen Aktivität eines Katalysators während einer chemischen Reaktion aufgrund des Vorhandenseins bestimmter Stoffe (so genannter Gifte oder giftiger Substanzen). Diese Gifte wirken stark chemisorbierend oder reagieren mit den aktiven Stellen des Katalysators und verhindern so, dass der Katalysator mit den Reaktanden in Kontakt kommt und normal reagiert. Die Vergiftung des Katalysators ist ein ungünstiges Phänomen, das zu einer Verringerung der Effizienz der chemischen Reaktion oder sogar zu ihrem vollständigen Abbruch führt.
3.2 Ursachen und Arten von Katalysatorvergiftungen
Es gibt drei Hauptmechanismen der Katalysatorvergiftung.
1. Chemische Adsorption: Starke chemische Adsorption von Giftmolekülen an den aktiven Stellen des Katalysators, so dass diese Stellen nicht mehr mit den Reaktanten reagieren können.
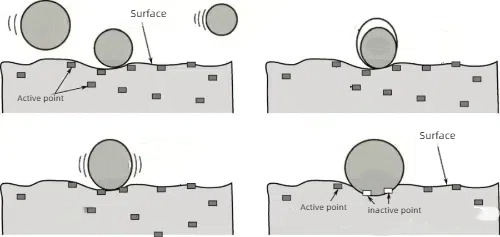
Abb. 6 Schematisches Prinzip der Chemisorption
2. Chemische Reaktion: Der Giftstoff reagiert mit den aktiven Bestandteilen des Katalysators und bildet inaktive Verbindungen, die die Katalysatoroberfläche bedecken.
3. Physikalische Blockade: Bestimmte Gifte lagern sich auf der Katalysatoroberfläche ab und blockieren die Poren oder aktiven Stellen des Katalysators auf physikalische Weise.
Die durch eine Katalysatorvergiftung verursachte Deaktivierung ist aufgrund verschiedener Ursachen und Grade unterschiedlich.
1. Vorübergehende Vergiftung (Reversible Vergiftung): Wenn das Gift an das aktive Zentrum adsorbiert oder chemisch gebunden wird, ist die erzeugte Bindungsstärke relativ schwach, und es können geeignete Maßnahmen ergriffen werden, um das Gift zu entfernen, so dass die Aktivität des Katalysators wiederhergestellt werden kann, ohne dass die Beschaffenheit des Katalysators beeinträchtigt wird; diese Art der Vergiftung wird als reversible Vergiftung oder vorübergehende Vergiftung bezeichnet.
2. Permanente Vergiftung (irreversible Vergiftung): Das Gift geht mit den aktiven Bestandteilen des Katalysators eine sehr starke chemische Bindung ein, und es ist schwierig, das Gift allgemein zu entfernen, um die Aktivität des Katalysators wiederherzustellen; diese Art der Vergiftung wird als irreversible Vergiftung oder permanente Vergiftung bezeichnet.
3. Selektive Vergiftung: Nach einer Vergiftung kann der Katalysator die katalytische Fähigkeit für eine bestimmte Reaktion verlieren, aber immer noch eine katalytische Aktivität für andere Reaktionen haben; dieses Phänomen wird als selektive Vergiftung bezeichnet. Wenn das Gift in einer Reihe von Reaktionen nur die aktive Stelle der nachfolgenden Reaktion vergiftet, kann die Reaktion im mittleren Stadium verbleiben und eine hohe Ausbeute an Zwischenprodukten erzielen.
4 Probleme, die durch Katalysatorvergiftung verursacht werden
4.1 Verminderte Katalysatoraktivität
1. Besetzung der aktiven Stellen: Toxine gehen eine starke chemische Bindung ein oder reagieren mit aktiven Stellen auf der Katalysatoroberfläche, wodurch diese Stellen vom Toxin besetzt werden und die Adsorption und Reaktion von Reaktionsmolekülen verhindert wird, was zu einer erheblichen Verringerung der Katalysatoraktivität führt. So reagieren beispielsweise Sulfide (z. B. H2S) mit der Oberfläche von Platin- oder Palladiumkatalysatoren und bilden Platinsulfid oder Palladiumsulfid, wodurch diese aktiven Stellen unbrauchbar werden.
2. Oberflächenbedeckung: Die Toxine bilden eine Deckschicht auf der Oberfläche des Katalysators, die physikalisch verhindert, dass die Reaktanten die aktiven Stellen des Katalysators erreichen. Durch diese Bedeckung wird auch die wirksame Oberfläche des Katalysators stark reduziert und seine Aktivität vermindert. So bilden beispielsweise Phosphate eine Deckschicht auf der Oberfläche einiger Katalysatoren, die die Adsorption von Reaktanten verhindert.
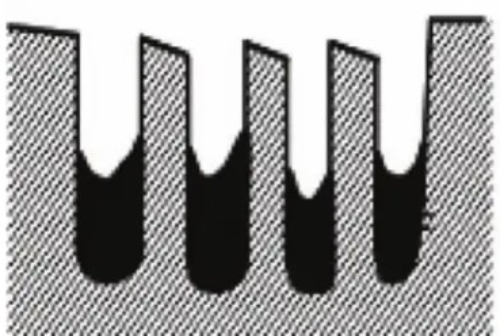
Abb. 7 Passivierte Katalysatorstruktur nach Oberflächenabdeckung
4.2 Selektive Veränderungen
1. Spezifische Belegung der aktiven Stellen
Bestimmte Giftstoffe binden selektiv an bestimmte aktive Stellen, was zu einer Veränderung der Aktivität und Funktion dieser Stellen führt. So können bestimmte Reaktionen von bestimmten Arten aktiver Stellen abhängen (z. B. Stellen auf bestimmten Kristallebenen oder in bestimmten atomaren Anordnungen), und die Adsorption von Schadstoffen besetzt bevorzugt diese Stellen, wodurch sich die Gesamtselektivität des Katalysators ändert.
Bei der selektiven Hydrierung von Ethylen weisen Pd-Katalysatoren beispielsweise eine hohe Selektivität auf. Wird die Katalysatoroberfläche jedoch durch Schwefel (S) vergiftet, adsorbieren Schwefelatome bevorzugt an den aktiven Stellen der Pd-Oberfläche, was die Oberflächeneigenschaften des Katalysators verändert und zu einer Reaktion führt, bei der eher unerwünschtes Ethan als Ethylen entsteht.
2. Änderung des Reaktionsverlaufs
Das Vorhandensein eines Giftstoffs kann den Weg einer katalysierten Reaktion verändern, auch wenn er die aktive Stelle nicht vollständig besetzt, indem er die elektronischen oder geometrischen Eigenschaften der Katalysatoroberfläche verändert, wodurch die Bildung bestimmter Zwischenprodukte oder Übergangszustände erschwert oder die Zersetzung wahrscheinlicher wird, was dazu führt, dass die Reaktion auf ein anderes Produkt ausgerichtet ist.
Ein typisches Beispiel ist die Veränderung der Elektronendichte auf der Oberfläche eines Rhodium (Rh)-Katalysators nach Vergiftung des Katalysators durch Phosphor (P) in der Propylen-Hydroformylierungsreaktion, was zu einer Verschiebung des erzeugten Hauptprodukts von n-Butyraldehyd zu Isobutyraldehyd führt, eine Veränderung der Selektivität, die auf die unterschiedliche stabilisierende Wirkung von Phosphor auf die Reaktionszwischenprodukte zurückzuführen ist.
3. Oberflächenumbau und geometrische Veränderungen
Die Adsorption von Schadstoffen an der Katalysatoroberfläche kann zu einer Neuanordnung oder einem Umbau von Atomen oder Molekülen auf der Katalysatoroberfläche führen, wodurch sich die Geometrie der Katalysatoroberfläche ändert und somit die Adsorptions- und Reaktionswege der Reaktionsmoleküle beeinflusst werden. Solche geometrischen Veränderungen können zu einer Verringerung oder einem vollständigen Verlust der Selektivität für bestimmte Reaktionen führen.
Bei der Fischer-Tropsch-Synthese werden Eisen (Fe)-Katalysatoren für die Synthese langkettiger Kohlenwasserstoffe verwendet. Wenn jedoch die Oberfläche des Fe-Katalysators durch Schwefel vergiftet wird, bewirken die Schwefelatome einen Oberflächenumbau, der die Bildung von langkettigen Kohlenwasserstoffen verringert und die Bildung von Methan und kurzkettigen Kohlenwasserstoffen erhöht. Diese Selektivitätsänderung ist auf die Veränderung der geometrischen Struktur der aktiven Stellen auf der Oberfläche zurückzuführen.
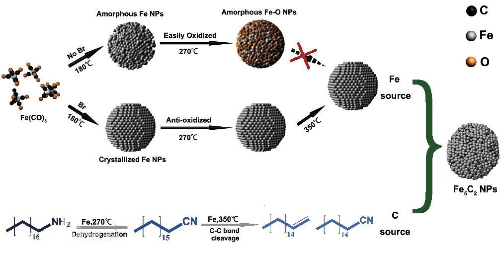
Abb. 8 Schematisches Prinzip des Fischer-Tropsch-Prozesses
4. Stabilitätsänderungen der Zwischenprodukte
Das Vorhandensein von Giftstoffen kann die Stabilität von Reaktionszwischenprodukten auf der Katalysatoroberfläche verändern, was zu einer leichteren Desorption oder einer schwierigeren Bildung bestimmter Zwischenprodukte führt und somit die Endproduktverteilung der Reaktion einschränkt.
Bei der Propylenoxidationsreaktion wird der Molybdän (Mo)-Katalysator zur Bildung von Acrolein verwendet. Wird der Katalysator jedoch durch Chlor (Cl) vergiftet, verändert das Chlor die Stabilität der reagierenden Zwischenprodukte (z. B. Propylenoxid), was zu einer Verringerung der Selektivität bei der Bildung von Acrolein und zu einer Zunahme der Bildung unvollständiger Oxidationsprodukte wie Kohlendioxid führt.
5. Elektronischer Effekt
Die Adsorption von Schadstoffen verändert die elektronische Umgebung auf der Katalysatoroberfläche und wirkt sich auf die Adsorptionsenergie und die Reaktionsenergiebarrieren der Reaktanten aus. Insbesondere wenn der Giftstoff stark elektronegativ ist oder einen Elektronendichteunterschied mit der Metalloberfläche bilden kann, kann dieser elektronische Effekt die Reaktionsselektivität des Katalysators erheblich verändern.
Bei der partiellen Oxidationsreaktion von Methanol werden Gold-(Au)-Katalysatoren zur Erzeugung von Formaldehyd verwendet, aber wenn Sauerstoff (O2) oder Oxide (z. B. Aluminiumoxid) vorhanden sind, verändern die adsorbierten Sauerstoffatome die Elektronendichte auf der Oberfläche der Goldkatalysatoren, was zu einer weiteren Oxidation von Formaldehyd zu Ameisensäure oder sogar Kohlendioxid führt, wodurch die Selektivität von Formaldehyd verringert wird.
4.3 Verkürzte Lebensdauer des Katalysators
Vergiftungserscheinungen sind oft irreversibel, vor allem wenn der Giftstoff stark mit dem Katalysator reagiert und eine stabile Verbindung bildet. Diese irreversible Deaktivierung bedeutet, dass der Katalysator nicht durch einfache Behandlungen (z. B. Regenerierung) nach längerer Zeit wieder aktiv werden kann, wodurch sich die Lebensdauer des Katalysators erheblich verkürzt.
Darüber hinaus kann die Wirkung von Giften zu Veränderungen der Oberflächenstruktur des Katalysators führen oder sogar eine Agglomeration oder Versinterung der Katalysatorpartikel verursachen, was die Stabilität und Lebensdauer des Katalysators weiter verringert.
4.4 Erhöhte Prozesskosten
Da das Phänomen der Vergiftung zu einer Verringerung der Katalysatoraktivität und -lebensdauer führt, muss der Katalysator bei diesem Verfahren häufiger ausgetauscht oder regeneriert werden, was die Produktionskosten erhöht. Darüber hinaus können vor der Reaktion komplexe Vorbehandlungen des Einsatzmaterials, wie Entschwefelung und Entphosphorung, erforderlich sein, um die Auswirkungen der Vergiftung zu verringern, was die Betriebskosten und die Investitionen in die Anlagen weiter erhöht.
5 Maßnahmen zur Bekämpfung von Katalysatorvergiftungen
5.1 Modifizierung des Katalysators
1. Legieren: Unter Legieren versteht man die Herstellung von legierten Katalysatoren mit verbesserten Eigenschaften durch die Kombination von Edelmetallen mit anderen Metallen. Mit dieser Methode lässt sich die Widerstandsfähigkeit des Katalysators gegen Toxizität wirksam verbessern. So wird beispielsweise Palladium (Pd) mit anderen Metallen wie Gold (Au) oder Silber (Ag) legiert, um seine Beständigkeit gegenüber Schwefel- und Stickstoffverbindungen zu verbessern.
Sulfide sind eines der häufigsten Katalysatorgifte, insbesondere bei der Erdölraffination und bei chemischen Prozessen. Durch die Legierung von Palladium (Pd) mit Gold (Au) oder Silber (Ag) kann die Beständigkeit eines Katalysators gegen Sulfide erheblich verbessert werden. Palladium-Gold-legierte Katalysatoren sind beispielsweise widerstandsfähiger gegen Sulfidvergiftungen als reine Palladiumkatalysatoren, da das Vorhandensein von Gold die elektronische Struktur der Katalysatoroberfläche verändert und die Schwefeladsorption verringert, wodurch sich die Vergiftungsrate verlangsamt.
Nitride sind auch eine der Hauptquellen für Katalysatorvergiftungen, insbesondere bei der Ammoniaksynthese und bei Denitrifikationsreaktionen. Durch Legierung von Palladium mit anderen Metallen wie Kupfer Cu oder Platin Pt kann die Toleranz des Katalysators gegenüber Nitriden verbessert werden. Durch die Legierung können die Elektronendichte und die Geometrie der Katalysatoroberfläche angepasst, die Adsorptionsstärke der Nitride verringert und die Deaktivierung des Katalysators verzögert werden.
2. Modifizierung der Oberfläche: Modifizierung der Katalysatoroberfläche, z. B. durch Aufbringen einer Oxid- oder Kohlenstoffschicht auf die Oberfläche des Edelmetallkatalysators, um zu verhindern, dass Giftstoffe direkt mit den aktiven Stellen in Kontakt kommen. Zum Beispiel Oxidbeschichtung und Modifizierung der Kohlenstoffschicht.
DasHinzufügen einer Oxidschicht, wie Aluminiumoxid (Al2O3) oder Siliziumdioxid (SiO2), auf die Oberfläche eines Edelmetallkatalysators kann die Widerstandsfähigkeit des Katalysators gegen Toxizität verbessern. So kann beispielsweise eine Aluminiumoxidbeschichtung auf der Oberfläche eines Palladiumkatalysators den Kontakt von Sulfiden mit den aktiven Stellen auf der Palladiumoberfläche wirksam blockieren und so die Sulfidbeständigkeit des Palladiumkatalysators verbessern. Darüber hinaus kann die Oxidbeschichtung zusätzliche saure oder basische Stellen bereitstellen, was die Selektivität und Aktivität des Katalysators weiter verbessert.
Das Aufbringen einer Kohlenstoffschicht auf die Oberfläche eines Edelmetallkatalysators ist ebenfalls eine wirksame Methode der Oberflächenmodifizierung. Die Kohlenstoffschicht kann den direkten Kontakt von Schadstoffen mit den aktiven Stellen des Katalysators durch Adsorption und Abschirmung verhindern. Durch Aufbringen einer Graphen- oder Aktivkohleschicht auf die Oberfläche eines Palladiumkatalysators kann beispielsweise dessen Toleranz gegenüber Sulfiden und Nitriden verbessert werden, während gleichzeitig eine gute katalytische Aktivität erhalten bleibt. Die Modifizierung der Kohlenstoffschicht verbessert nicht nur die Toxizitätsresistenz des Katalysators, sondern erhöht auch seine thermische Stabilität und mechanische Festigkeit.
5.2 Vorbehandlung von Rohstoffen
Die Vorbehandlung der Rohstoffe ist ein wichtiger Schritt, um eine Vergiftung des Edelmetallkatalysators zu vermeiden. Durch eine wirksame Entschwefelung, Entphosphorung und Entstickung kann die Wirkung von Giften auf den Katalysator erheblich reduziert, die Lebensdauer des Katalysators verlängert und seine effiziente katalytische Leistung erhalten werden.
1. Entschwefelung: Unter Entschwefelung versteht man die Entfernung von Sulfiden aus dem Ausgangsmaterial vor der Reaktion, um die Vergiftung des Katalysators durch Sulfide zu verhindern. Sulfide sind eines der häufigsten Katalysatorgifte, insbesondere bei der Erdölraffination und der chemischen Produktion, wo sie mit den aktiven Stellen auf der Katalysatoroberfläche reagieren und zur Deaktivierung des Katalysators führen. Die Hydrodesulfurierung ist eine gängige Entschwefelungstechnologie, bei der Schwefelwasserstoff aus dem Ausgangsmaterial entfernt wird, indem das Sulfid bei hoher Temperatur und hohem Druck mit wasserstoffhaltigem Hydriergas in Schwefelwasserstoff (H₂S) umgewandelt wird. Mit dieser Methode werden schwefelorganische Verbindungen wie Mercaptane, Thioether und Thioester wirksam aus dem Ausgangsmaterial entfernt, wodurch die toxische Wirkung dieser Sulfide auf den Katalysator verringert wird.
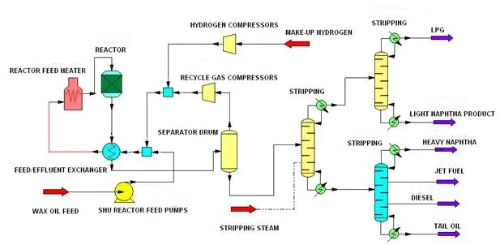
Abb. 9 Hydrodesulfurierungsverfahren
2. Dephosphorierung: Phosphid ist ebenfalls eine der Hauptquellen für die Vergiftung des Katalysators, insbesondere bei bestimmten katalytischen Reaktionen reagiert Phosphid mit der Katalysatoroberfläche und führt zum Ausfall der aktiven Stelle. Daher ist es sehr wichtig, das Rohmaterial mit einem Entphosphorierungsmittel zu entphosphorisieren. Ein Entphosphorierungsmittel ist ein chemisches Reagens, das speziell zur Entfernung von Phosphid aus dem Rohmaterial entwickelt wurde. Das Entphosphorierungsmittel reagiert mit den Phosphiden im Rohmaterial und bildet einen festen Niederschlag, der im Rohmaterial unlöslich ist und sie somit entfernt. In einigen industriellen Verfahren können beispielsweise Entphosphorierungsmittel auf Kalziumbasis verwendet werden, um mit Phosphaten zu reagieren und Kalziumphosphatausfällungen zu bilden, wodurch der Zweck der Entphosphorierung erreicht wird.
3. Denitrogenierung: Stickstoffhaltige Verbindungen sind ebenfalls eine der Hauptursachen für Katalysatorvergiftungen, insbesondere bei petrochemischen und organischen Synthesereaktionen, bei denen sich Stickstoffverbindungen mit den aktiven Stellen des Katalysators verbinden und zur Deaktivierung des Katalysators führen. Um dies zu vermeiden, ist eine Denitrifikation des Ausgangsmaterials erforderlich. Stickstoffhaltige Verbindungen sind auch eine der wichtigsten Ursachen für Katalysatorvergiftungen, insbesondere bei petrochemischen und organischen Synthesereaktionen, bei denen sich Nitride mit den aktiven Stellen des Katalysators verbinden, was zur Deaktivierung des Katalysators führt. Um diese Situation zu vermeiden, ist die Denitrifikation von Rohstoffen erforderlich.
5.3 Optimierung der Reaktionsbedingungen
1. Steuerung der Reaktionstemperatur: Die Reaktionstemperatur hat einen direkten Einfluss auf die Aktivität und Stabilität des Katalysators. Das Adsorptions- und Desorptionsverhalten von Reaktanten und Zwischenprodukten sowie die Generationsrate von Giften ändert sich bei unterschiedlichen Temperaturbedingungen. Durch Optimierung der Reaktionstemperatur kann die Bildung und Adsorption von Giftstoffen verringert werden. Durch die Durchführung der Reaktion bei niedrigeren Temperaturen wird die Entstehung bestimmter toxischer Nebenprodukte verringert. Viele Giftstoffe (z. B. Sulfide, Phosphide) bilden sich leichter bei höheren Temperaturen, und eine Senkung der Reaktionstemperatur kann die Bildung dieser Nebenprodukte verhindern. So kann beispielsweise bei der Hydrodesulfurierung (HDS) die Bildung von Schwefelwasserstoff (H₂S) durch Senkung der Reaktionstemperatur verringert werden, wodurch der Katalysator vor einer Sulfidvergiftung geschützt wird. Niedrige Temperaturen tragen dazu bei, die Adsorption von Giftstoffen an der Katalysatoroberfläche zu verringern. Hohe Temperaturen erhöhen die kinetische Energie von Reaktanten und Giften, so dass sie sich leichter mit den aktiven Stellen auf der Katalysatoroberfläche chemisorbieren können, was zu einer Vergiftung des Katalysators führen kann. Durch Kontrolle der Reaktionstemperatur kann die Adsorption von Giften verringert und der aktive Zyklus des Katalysators verlängert werden.
2. Kontrolle des Wasserstoffdrucks: Bei der Hydrierungsreaktion ist der Wasserstoffdruck ein Schlüsselparameter, der die Reaktionsgeschwindigkeit und die Selektivität des Katalysators direkt beeinflusst. Durch die Optimierung des Wasserstoffdrucks können eine übermäßige Hydrierung und die Bildung von Giften wirksam reduziert werden, wodurch der Edelmetallkatalysator vor Vergiftungen geschützt wird. Bei Hydrierungsreaktionen kann ein zu hoher Wasserstoffdruck zu einer übermäßigen Hydrierung der Reaktanten und zur Bildung unerwünschter vollständig hydrierter Produkte führen. Beispielsweise kann bei einer partiellen Hydrierungsreaktion von Alkinen ein zu hoher Wasserstoffdruck zu einer Überhydrierung der Alkine zu Alkanen anstelle des Zielprodukts Olefine führen. Durch die Steuerung des Wasserstoffdrucks kann der Grad der Hydrierung der Reaktanten genau geregelt werden, um eine Überhydrierung zu vermeiden, wodurch die Reaktionsselektivität verbessert und die Aktivität des Katalysators geschützt wird. Der Wasserstoffdruck beeinflusst auch die Entstehung von Giften. Bei einigen Reaktionen kann ein zu hoher Wasserstoffdruck das Auftreten von Nebenreaktionen und die Bildung von toxischen Nebenprodukten fördern. Beispielsweise kann bei der partiellen Oxidation von Methan ein zu hoher Wasserstoffdruck zu einer weiteren Oxidation von Formaldehyd zu Ameisensäure oder Kohlendioxid führen und damit die Toxizität der Gifte für den Katalysator erhöhen. Durch Optimierung des Wasserstoffdrucks kann das Auftreten dieser Nebenreaktionen verhindert, die Bildung von Giften verringert und die Aktivität des Katalysators geschützt werden.
5.4 Regenerierung des Katalysators
Die Regeneration von Katalysatoren ist ein wichtiger Teil des Verfahrens zur Vermeidung der Vergiftung von Edelmetallkatalysatoren. Katalysatoren werden im Laufe ihrer Nutzung unweigerlich durch Gifte verunreinigt, was zu einer Abnahme der katalytischen Aktivität führt. Durch geeignete Regenerationstechniken können die Gifte auf der Katalysatoroberfläche entfernt und die katalytische Leistung wiederhergestellt werden.

Abb. 10 Vergleich des Aussehens verschiedener Katalysatoren vor und nach der Regenerierung
1. Chemische Regenerierung: Entfernung der Gifte auf der Katalysatoroberfläche durch chemische Methoden wie Oxidations- oder Reduktionsbehandlung. Diese Methode umfasst in der Regel eine oxidierende und eine reduzierende Behandlung.
Bei der Oxidationsbehandlung werden die Giftstoffe auf der Katalysatoroberfläche entfernt, indem Sauerstoff oder andere Oxidationsmittel zugeführt werden, um die organischen Giftstoffe oder andere oxidierbare Substanzen auf der Katalysatoroberfläche zu oxidieren und zu zersetzen. Bei einem mit Kohlenwasserstoffen verunreinigten Katalysator kann zum Beispiel Luft oder Sauerstoff bei hoher Temperatur zugeführt werden, um die Kohlenwasserstoffe auf der Oberfläche zu Kohlendioxid und Wasser zu oxidieren und so die Giftstoffe zu entfernen.
Bei Katalysatoren, die mit reduzierenden Giften verunreinigt sind, werden Reduktionsbehandlungen durchgeführt, bei denen ein Reduktionsmittel, wie z. B. Wasserstoff, zugeführt wird, um ihre Aktivität wiederherzustellen. So kann beispielsweise ein durch Sulfid vergifteter Palladiumkatalysator einer Reduktionsbehandlung unter Wasserstoffatmosphäre unterzogen werden, um das Palladiumsulfid auf der Oberfläche in metallisches Palladium und Schwefelwasserstoffgas umzuwandeln, wodurch das Gift entfernt und die Aktivität des Katalysators wiederhergestellt wird.
2. Thermische Behandlung Regeneration: Entfernen von organischen Giften oder Koksablagerungen auf der Katalysatoroberfläche durch Rösten bei hoher Temperatur, um die Aktivität des Katalysators wiederherzustellen. Diese Methode umfasst die Röstung und die Pyrolysebehandlung.
Beim Hochtemperaturrösten wird der Katalysator bei hohen Temperaturen behandelt, um die organischen Giftstoffe oder Kohlenstoffablagerungen auf der Oberfläche durch thermische Zersetzung oder Verbrennung zu entfernen. Beispielsweise kann ein Katalysator, der durch Koksablagerungen vergiftet ist, durch Rösten bei hoher Temperatur behandelt werden, um den Koks auf der Oberfläche abzubrennen und so die Gifte zu entfernen und die Aktivität des Katalysators wiederherzustellen. Die Rösttemperatur und die Röstdauer müssen je nach Art des Katalysators und der Art des Giftes optimiert werden, um eine wirksame Entfernung des Giftes ohne Beschädigung der Katalysatorstruktur zu gewährleisten.
Bei der Pyrolysebehandlung werden die Gifte entfernt, indem die organischen Gifte auf der Katalysatoroberfläche bei hohen Temperaturen in flüchtige Produkte zersetzt werden. Bei Katalysatoren, die beispielsweise durch Organophosphate vergiftet sind, kann eine Pyrolysebehandlung bei hohen Temperaturen durchgeführt werden, um die Phosphide in gasförmige Produkte zu zersetzen, wodurch die Gifte entfernt werden und die Aktivität des Katalysators wiederhergestellt wird.
5.5 Verwendung von selektiven Toxizitätsinhibitoren
Die Zugabe von Co-Katalysatoren zum Reaktionssystem kann ebenfalls zum Schutz von Edelmetallkatalysatoren beitragen. So können beispielsweise kleine Mengen von Metalloxiden Giftstoffe adsorbieren oder umwandeln und so die Aktivität des Katalysators schützen. Bei Palladiumkatalysatorsystemen kann der Zusatz geringer Mengen von Lanthan- (La) oder Ceroxiden (Ce) die Schwefelresistenz des Katalysators erheblich verbessern. Diese Metalloxide reagieren mit den Giftstoffen und verhindern, dass sie sich an den Edelmetallkatalysator binden, wodurch die Lebensdauer des Katalysators verlängert und seine Effizienz erhalten wird.
5.6 Fortgeschrittene Katalysatorkonzepte
1. Kern-Schale-Katalysatoren: Kern-Schale-Katalysatoren sind ein Katalysatordesign, bei dem der aktive Metallkern in einer stabilen Schalenschicht eingekapselt ist. Ein Kern-Schale-Katalysator besteht aus einem Kern (aktives Metall) und einer Schale (Schutzschicht). Die Schale besteht in der Regel aus einem stabilen Material mit guter Toxizitätsresistenz, wie z. B. mesoporöse Siliziumdioxidoxide, Kohlenstoffmaterialien oder Aluminiumoxid. Das Schalenmaterial ermöglicht es den Reaktanten, die aktiven Stellen des Kerns zu erreichen, indem es geeignete Porengrößen und Kanäle vorsieht und gleichzeitig den Eintritt von makromolekularen Giften blockiert. Dank dieser Struktur kann der aktive Metallkern nur durch Mikroporen oder Nanokanäle hindurchgehen, wenn er mit den Reaktanten in Kontakt kommt, wodurch wirksam verhindert wird, dass Gifte in direkten Kontakt kommen und an der aktiven Metalloberfläche adsorbiert werden. Im Falle von Palladium (Pd) beispielsweise können Katalysatoren, bei denen der Palladiumkern von mesoporösen Siliziumoxiden (SiO2) eingekapselt ist, wesentlich resistenter gegen Vergiftungen sein. Bei dieser Struktur sorgt der Palladiumkern für eine effiziente katalytische Aktivität, während die mesoporöse SiO2-Hüllschicht durch ihre Selektivität der Porengröße das Eindringen kleiner Moleküle in den und die Reaktion mit dem Palladiumkern ermöglicht, während große Molekülgifte blockiert werden, wodurch eine Vergiftung des Palladiumkerns wirksam verhindert wird.
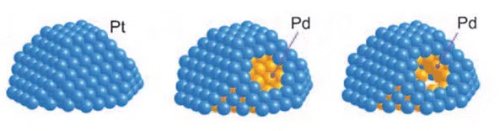
Abb. 11 Die Struktur des Pt-Pd-Kern-Schale-Katalysators
2. Monoatomare Katalysatoren: Monoatomare Katalysatoren werden hergestellt, indem die aktiven Metallatome auf der Oberfläche des Trägers hochgradig dispergiert werden, so dass jede aktive Stelle aus einem einzigen Atom besteht. Diese hochdisperse Struktur maximiert die Nutzung der Metallatome und erhöht die Aktivität und Selektivität des Katalysators erheblich. Da jedes Metallatom unabhängig voneinander vorhanden ist, können sich Giftstoffe nur schwer an der Oberfläche anlagern, was das Risiko einer Vergiftung des Katalysators verringert. Einatomige Palladiumkatalysatoren können zum Beispiel auf stickstoffdotierten Kohlenstoffträgern hoch dispergiert sein. Jedes Palladiumatom wird auf den stickstoffdotierten Stellen durch starke Wechselwirkungen stabilisiert, und dieses Design erhöht nicht nur die katalytische Aktivität, sondern verbessert auch die Widerstandsfähigkeit des Katalysators gegenüber Giftstoffen erheblich. Da es für Gifte schwierig ist, sich um einzelne Palladiumatome herum anzusammeln, ist der Katalysator wesentlich widerstandsfähiger gegen Vergiftungen.
5.7 Grüne katalytische Verfahren
Die folgenden spezifischen Maßnahmen können ergriffen werden, um das Toxizitätsproblem herkömmlicher Katalysatoren zu verringern. Erstens: Verwendung umweltfreundlicher Lösungsmittel wie Wasser oder überkritischesCO₂ anstelle von giftigen organischen Lösungsmitteln, um die Vergiftungswirkung von Giften auf den Katalysator zu verringern. Dadurch wird nicht nur die Sicherheit der Reaktion verbessert, sondern auch die Umweltverschmutzung verringert. Zweitens werden neue katalytische Systeme entwickelt, z. B. durch die Erforschung und Entwicklung neuer Technologien wie der Enzymkatalyse oder der Photokatalyse. Die Enzymkatalyse ermöglicht grüne chemische Reaktionen durch die hohe Selektivität und Effizienz biologischer Enzyme, während die Photokatalyse Lichtenergie zum Antrieb des Reaktionsprozesses nutzt und das Vergiftungsproblem herkömmlicher Katalysatoren vermeidet. Diese innovativen Ansätze verbessern nicht nur die Effizienz der Reaktion, sondern verringern auch die negativen Auswirkungen auf die Umwelt und die Gesundheit.
6 Schlussfolgerung
Edelmetallkatalysatoren spielen in der chemischen Industrie, bei der Energieumwandlung und im Umweltschutz aufgrund ihrer effizienten katalytischen Leistung und ihres breiten Anwendungsspektrums eine unersetzliche Rolle. Die Toxizität der Katalysatoren schränkt jedoch ihren langfristig stabilen Betrieb und ihre Anwendungseffekte stark ein. Durch eine eingehende Untersuchung des Mechanismus von Edelmetallkatalysatoren und der Ursachen des Vergiftungsphänomens können wir verschiedene Maßnahmen ergreifen, um die Anti-Vergiftungsfähigkeit und die Lebensdauer von Katalysatoren zu verbessern.
Erstens kann die Katalysatormodifikation, wie z. B. Legierung und Oberflächenmodifikation, die Vergiftungsschutzleistung von Katalysatoren erheblich verbessern. Zweitens können die Vorbehandlung des Ausgangsmaterials und die Optimierung der Reaktionsbedingungen die Bildung und Adsorption von Giftstoffen wirksam verringern. Darüber hinaus können die Regeneration des Katalysators und die Verwendung selektiver Schadstoffinhibitoren zur Wiederherstellung und Aufrechterhaltung der Katalysatoraktivität beitragen. Fortgeschrittene Katalysatorkonstruktionen, wie Katalysatoren mit Kern-Schale-Struktur und Ein-Atom-Katalysatoren, bieten neue Wege zur Bekämpfung von Vergiftungen. Schließlich trägt die Anwendung grüner katalytischer Verfahren nicht nur zur Verringerung der Vergiftungsprobleme bei, sondern fördert auch den Prozess der nachhaltigen Entwicklung.
Zusammenfassend lässt sich sagen, dass die Leistung und Lebensdauer von Edelmetallkatalysatoren durch die kombinierte Anwendung dieser Strategien erheblich verbessert werden kann, wodurch der Bedarf an effizienten, stabilen und umweltfreundlichen Katalysatoren in der industriellen Produktion gedeckt wird. Die künftige Forschung sollte sich weiterhin der Entwicklung neuer Katalysatoren gegen Vergiftungen und grüner katalytischer Technologien widmen, um die breite Anwendung von Edelmetallkatalysatoren in verschiedenen Bereichen weiter zu fördern.
Weiterführende Lektüre:
Anwendungen von Edelmetallkatalysatoren: Einblicke in Pulver vs. Pellets
Referenzen:
[1] Qin T, Li N, Ma H, et al. Auswirkungen von Metallen der Gruppe VIII auf die Pyrolyse von Braunkohle und die Vergasung von Holzkohle mit einem Katalysator auf Ca-Basis[J]. Fuel, 2024, 372.
[2] Lysne A, Saxrud I, Snidaro L R, et al. Edelmetall (Pt, Pd und Rh) geförderte Ni-Co/Mg (Al)O Katalysatoren für die Dampfreformierung von Teerverunreinigungen aus der Biomassevergasung[J]. Journal of Catalysis, 2024, 436.
[3] Nejadmoghadam E, Achour A, Öhrman O, et al. Stabilisierung von frischem und gealtertem simuliertem Pyrolyseöl durch milde Hydrobehandlung mit Edelmetallkatalysatoren[J]. Energy Conversion and Management, 2024, 313.
[4] Li L, Chen T, Zhang L, et al. Jüngste Fortschritte bei Nanomaterialien auf Ni-Basis als Promotor zur Verbesserung der Wasserstoffentwicklungsreaktionsleistung von Edelmetallkatalysatoren[J]. Journal of Alloys and Compounds, 2024, 998.
[5] Yun W, Rui Y, Qiang Z, et al. La-RuO2-Nanokristalle mit effizienter elektrokatalytischer Aktivität für die gesamte Wasserspaltung in sauren Medien: Synergistischer Effekt von La-Dotierung und Sauerstoffleere[J]. Chemical Engineering Journal, 2022, 439.

 Bars
Bars
 Perlen & Kugeln
Perlen & Kugeln
 Bolzen & Muttern
Bolzen & Muttern
 Tiegel
Tiegel
 Scheiben
Scheiben
 Fasern & Stoffe
Fasern & Stoffe
 Filme
Filme
 Flocke
Flocke
 Schaumstoffe
Schaumstoffe
 Folie
Folie
 Granulat
Granulat
 Honigwaben
Honigwaben
 Tinte
Tinte
 Laminat
Laminat
 Klumpen
Klumpen
 Maschen
Maschen
 Metallisierte Folie
Metallisierte Folie
 Platte
Platte
 Pulver
Pulver
 Stab
Stab
 Blätter
Blätter
 Einkristalle
Einkristalle
 Sputtering Target
Sputtering Target
 Rohre
Rohre
 Waschmaschine
Waschmaschine
 Drähte
Drähte
 Umrechner & Rechner
Umrechner & Rechner
 Schreiben Sie für uns
Schreiben Sie für uns
 Chin Trento
Chin Trento


