Vergleichende Einblicke in Edelmetallkatalysatoren: Pulver vs. Pellet-Formen
1 Einleitung
Edelmetallkatalysatoren sind aufgrund ihrer einzigartigen elektronischen Struktur und chemischen Stabilität für viele Reaktionsprozesse in der chemischen Industrie unerlässlich. Sie weisen eine hervorragende Leistung in Bezug auf Selektivität, Synergismus und Stabilität auf und spielen eine Schlüsselrolle, insbesondere in zwei wichtigen industriellen Reaktoren, den Kessel- und Festbettreaktionen. Die Partikelgröße und -form von Edelmetallkatalysatoren haben einen erheblichen Einfluss auf die Reaktionseffizienz und die Produktselektivität, so dass das Verständnis und die Optimierung dieser Parameter für die Erzielung effizienter katalytischer Prozesse von wesentlicher Bedeutung sind.
2 Merkmale von Edelmetallkatalysatoren
Edelmetallatome haben aufgrund der d-Elektronen in ihren äußersten Schichten eine besondere Aktivität. Dies spiegelt sich in der Leichtigkeit wider, mit der sie Sauerstoff- und Wasserstoffatome zu kovalenten Bindungen verbinden können, wodurch die ursprünglichen Oxidations- und Reduktionsprozesse leichter durchgeführt werden können. Daher können Edelmetallmonomere, -oxide und -komplexe als Katalysatoren verwendet werden. Edelmetallkatalysatoren sind in ihrer Wirkung selektiv, synergistisch und stabil.
1. Selektivität: Bei katalysierten Reaktionen gibt es in der Regel mehrere mögliche Reaktionswege und Wege der Produktbildung. Die Selektivität des Katalysators wirkt sich auf die Energiebarrieren der verschiedenen Wege aus und bestimmt, welche Hauptprodukte unter einer bestimmten Reaktionsbedingung entstehen und in welchem Verhältnis sie zueinander stehen. Unterschiedliche Edelmetallkatalysatoren für dieselbe Reaktion führen zu unterschiedlichen Produkten und entsprechenden Anteilen; derselbe Edelmetallkatalysator katalysiert unterschiedliche Reaktionen mit unterschiedlichen Ergebnissen.
2. Synergistischer Effekt: Edelmetallkatalysatoren können in Kombination miteinander verwendet werden, so dass die Aktivität der katalytischen Reaktion stark erhöht werden kann. Darüber hinaus können Edelmetalle und andere Metalle binäre oder Mehrfachlegierungen mit unterschiedlichen Morphologien und unterschiedlichen Verhältnissen bilden, wodurch nicht nur die Menge der verwendeten Edelmetalle reduziert, sondern auch die Selektivität und Lebensdauer der katalytischen Reaktion verbessert werden kann. Wenn Edelmetallkatalysatoren in Kombination mit verschiedenen Trägern verwendet werden, variiert die katalytische Leistung, die durch verschiedene Zubereitungsmethoden erzielt wird, stark. Aufgrund des Synergieeffekts von Edelmetallkatalysatoren sind auch die Einsatzmöglichkeiten und Forschungsgebiete sehr vielfältig.
3. Beständigkeit: Edelmetalle sind von Natur aus chemisch stabil; sie lassen sich nicht leicht oxidieren und werden von allgemeinen Säuren und Basen nicht angegriffen. Außerdem haben sie einen hohen Schmelzpunkt, eine gute thermische Stabilität und verändern ihre Eigenschaften unter den meisten Reaktionsbedingungen nicht. Edelmetalle sind unter normalen Bedingungen nicht anfällig für die Bildung von Halogeniden oder Sulfiden und werden daher nicht leicht vergiftet. Edelmetalle können durch die Adsorption von Schwefel oder CO kurzzeitig deaktiviert werden, können aber unter bestimmten Bedingungen desorbiert und reaktiviert werden und werden durch die Bildung stabiler Carbonylverbindungen oder Sulfide nicht dauerhaft deaktiviert. Andererseits hat die Stabilität von Edelmetallkatalysatoren auch den Nachteil, dass sie nicht leicht zu eluieren und nur schwer wiederzugewinnen sind.
4. Katalytische Aktivität: Sie ist die wichtigste Eigenschaft, die die katalytische Effizienz eines Katalysators misst. Im Vergleich zu gewöhnlichen Katalysatoren ist die Aktivität von Edelmetallkatalysatoren in der Regel besser. Aufgrund ihrer besonderen elektronischen Struktur und Gittermorphologie können Edelmetalle bei katalytischen Reaktionen hochaktive oberflächenaktive Stellen bereitstellen. Diese aktiven Stellen sind in der Lage, Reaktanten zu adsorbieren und zu aktivieren und die Energiebarrieren zwischen den Reaktanten zu senken, wodurch die Reaktionsgeschwindigkeit beschleunigt wird. Die katalytische Aktivität von Edelmetallen in Verbindung mit ihrer hohen Selektivität und Stabilität macht ihre katalytische Leistung für den Reaktionsprozess weitaus besser als die von herkömmlichen Katalysatoren.
Abb. 1 Mechanismus der Katalysatorwirkung
3 Reaktortechnologien: Kessel- und Festbettsysteme
3.1 Kesselreaktoren: Funktionsweise und Verwendung von Katalysatoren
Der Kesselreaktor, auch als Reaktionskessel bezeichnet, ist eine Art Ausrüstung für die Durchführung des Reaktionsprozesses. Er wird zur Durchführung von Einphasenreaktionen in der Flüssigphase und von Mehrphasenreaktionen in den Phasen flüssig-flüssig, gas-flüssig, flüssig-fest, gas-flüssig-fest usw. verwendet. Im Allgemeinen ist die Größe des Reaktors relativ groß und die Menge des Reaktionsmaterials ist groß. Um vollen Kontakt mit dem Reaktionsmaterial Reaktion zu machen, ist das Gerät oft gerührt (mechanisches Rühren, Luftstrom Rühren, etc.) Gerät, in der hohen Durchmesser ist relativ groß, und kann in mehrschichtigen Rühren Paddel verwendet werden. Der Kesselreaktor ist so konzipiert, dass er den hohen Temperaturen und Drücken des Reaktionsprozesses standhält. Während dieses Prozesses müssen die Materialien möglicherweise erwärmt oder gekühlt werden. Diese Temperaturregelung kann durch die Anbringung eines Mantels an der Reaktorwand oder durch die Einrichtung von Wärmeaustauschflächen innerhalb des Geräts erreicht werden. Zusätzlich kann eine externe Zirkulation für den Wärmeaustausch genutzt werden, um die Temperatur je nach Bedarf zu kontrollieren und anzupassen.
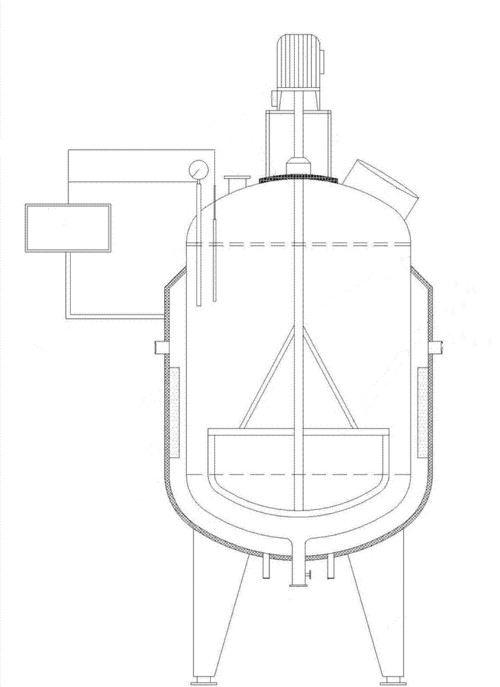
Abb. 2 Schematischer Aufbau eines Reaktionskessels
Die Reaktortypen lassen sich je nach Betriebsweise in Chargenreaktoren und kontinuierliche Reaktoren unterteilen. Beim Chargenreaktor werden die Rohstoffe einmal in einem bestimmten Verhältnis in den Reaktor gegeben und einmal entladen, nachdem die Reaktion eine bestimmte Anforderung erreicht hat, während beim kontinuierlichen Betrieb die Rohstoffe kontinuierlich zugegeben und die Reaktionsprodukte kontinuierlich entladen werden.
Batch-Reaktor: Der Chargenreaktor ist flexibel im Betrieb, lässt sich leicht an unterschiedliche Betriebsbedingungen und Produktvarianten anpassen und eignet sich für kleine Chargen, mehrere Arten und lange Reaktionszeiten bei der Produktherstellung. Gleichzeitig findet keine Vermischung der Materialien statt, was für die meisten Reaktionen vorteilhaft ist. Der Nachteil ist, dass Hilfsvorgänge wie das Be- und Entladen erforderlich sind und die Produktqualität nicht leicht zu stabilisieren ist.
Kontinuierlicher Reaktor: Die Vorteile eines kontinuierlichen Reaktors sind die stabile Produktqualität und die einfache Bedienung und Kontrolle. Der Nachteil ist, dass es unterschiedliche Grade der Rückvermischung gibt, was für die meisten Reaktionen ungünstig ist und durch eine vernünftige Auswahl und bauliche Gestaltung des Reaktors unterdrückt werden sollte.
3.2 Festbettreaktoren: Leistung und Rolle des Katalysators
Unter Festbettreaktor versteht man einen Reaktor, der mit körnigem Feststoffkatalysator oder festen Reaktanden gefüllt ist, die eine bestimmte Höhe des Stapelbetts bilden, wobei Gas oder flüssige Stoffe durch den Partikelspalt gleichzeitig durch das stationäre Festbett fließen, um einen inhomogenen Reaktionsprozess zu erreichen. Es handelt sich um eine Art heterogenen katalytischen Reaktor. Diese Art von Reaktor zeichnet sich dadurch aus, dass die Feststoffpartikel in der Anlage fest verankert sind, im Gegensatz zu den Feststoffen in der Anlage, die sich im beweglichen Bett und im Wirbelbett bewegen, auch bekannt als Füllbettreaktor. Festbettreaktoren werden häufig bei Gas-Festphasenreaktionen und Flüssig-Festphasenreaktionen eingesetzt, wie z. B. der Festbett-Gasgenerator in der Ammoniakindustrie und die Festbett-Ionenaustauschersäule in der Wasseraufbereitung.
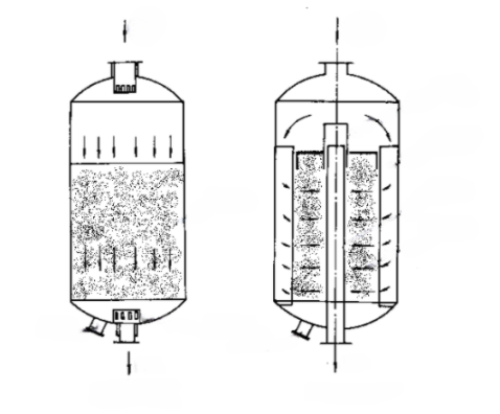
Abb. 3 Schematische Darstellung von zwei Arten von Festbettreaktoren: Axialer Reaktor und Radialer Reaktor
Zu den Vorteilen von Festbettreaktoren gehören eine geringe Rückvermischung, ein effektiver Kontakt zwischen Flüssigkeit und Katalysator sowie eine hohe Selektivität, wenn die Reaktion von Tandem-Nebenreaktionen begleitet wird. Da der Katalysator im Reaktor fixiert ist, kommt es außerdem zu einem geringeren mechanischen Verlust des Katalysators in der mobilen Phase als bei der Kesselreaktion. Gleichzeitig ist jedoch die Wärmeübertragung des Festbettreaktors schlecht, und wenn die exotherme Reaktionswärme sehr groß ist, kann es sogar im Rohrreaktor zu fliegenden Temperaturen kommen (das Phänomen, dass die Reaktionstemperatur außer Kontrolle gerät und stark über den zulässigen Bereich ansteigt). In der Festbettreaktor Betrieb Prozess Katalysator kann nicht ersetzt werden, der Katalysator erfordert häufige Regeneration der Reaktion ist in der Regel nicht anwendbar, oft durch ein Wirbelbettreaktor oder Wanderbettreaktor ersetzt.
Es gibt drei Grundformen von Festbettreaktoren. Die eine ist der axiale adiabatische Festbettreaktor. Die Flüssigkeit fließt in axialer Richtung von oben nach unten durch das Bett, und es findet kein Wärmeaustausch zwischen dem Bett und der Außenwelt statt. Der zweite ist ein radialer adiabatischer Festbettreaktor. Die Flüssigkeit strömt in radialer Richtung durch das Bett, wobei es sich um eine zentrifugale oder zentripetale Strömung handeln kann, und es findet kein Wärmeaustausch zwischen dem Bett und der Außenwelt statt. Radialreaktoren und Axialreaktoren haben eine kürzere Strömungsdistanz, eine größere Querschnittsfläche des Strömungskanals und einen geringeren Druckabfall der Flüssigkeit. Allerdings ist die Struktur des Radialreaktors komplexer als die des Axialreaktors. Die beiden oben genannten Formen sind adiabatische Reaktoren, anwendbar auf die Reaktion thermische Wirkung ist nicht groß, oder das Reaktionssystem kann die adiabatischen Bedingungen durch die Reaktion thermische Wirkung von Temperaturänderungen in der Gelegenheit verursacht zu widerstehen. Der dritte ist der Säulen-Rohr-Festbettreaktor, der aus mehreren parallel geschalteten Reaktionsrohren besteht. Der Katalysator ist in oder zwischen den Rohren angeordnet, und der Wärmeträger wird durch die Rohre oder im Inneren der Rohre erhitzt oder gekühlt. Der Durchmesser der Rohre liegt in der Regel zwischen 25 und 50 mm, und die Anzahl der Rohre kann bis zu Zehntausenden betragen. Rohrfestbettreaktoren eignen sich für Reaktionen mit großen thermischen Effekten. Darüber hinaus gibt es auch die oben genannte Grundform der Reihenkombination von Reaktoren, die als mehrstufige Festbettreaktoren bezeichnet werden. Zum Beispiel: Wenn der thermische Effekt der Reaktion groß ist oder die Temperatur abschnittsweise kontrolliert werden muss, können mehrere adiabatische Reaktoren in Reihe zu einem mehrstufigen adiabatischen Festbettreaktor geschaltet werden, wobei ein Wärmetauscher zwischen den Reaktoren oder zusätzliche Materialien zur Temperaturregulierung eingesetzt werden, um nahe an den optimalen Temperaturbedingungen zu arbeiten.
4 Anwendung von Edelmetallkatalysatoren in Reaktortechnologien
4.1 Pulverform in Kesselreaktoren
In der chemischen Produktion werden Edelmetallkatalysatoren aufgrund ihrer effizienten katalytischen Aktivität und Selektivität in einer Vielzahl von chemischen Reaktionen eingesetzt. Insbesondere in Kesselreaktoren liegen Edelmetallkatalysatoren in Pulverform vor und bieten eine große spezifische Oberfläche, die den Kontakt zwischen den Reaktanten und den Katalysatoren verbessert und so die Reaktionsgeschwindigkeit beschleunigt. Hochdisperse Edelmetallpulverkatalysatoren werden in vielen organischen Synthesereaktionen wie Hydrierung, Carbonylierung und Kupplungsreaktionen eingesetzt. Diese Katalysatoren werden in der Regel durch Mischen einer Edelmetallvorläuferlösung mit einem Träger und anschließender Reduktionsbehandlung hergestellt. Aufgrund ihrer hohen Dispergierbarkeit und großen spezifischen Oberfläche weisen diese Pulverkatalysatoren eine ausgezeichnete katalytische Leistung bei Kesselreaktionen auf. Um die Effizienz der Edelmetallnutzung weiter zu verbessern, haben Wissenschaftler Ein-Atom-Katalysatoren entwickelt. Diese Katalysatoren erreichen eine extrem hohe katalytische Effizienz und einen geringen Edelmetallverbrauch, indem sie einzelne Edelmetallatome auf einem Träger mit großer spezifischer Oberfläche hoch dispergieren. Bei Flüssigphasenreaktionen, wie z. B. Hydrierung und Oxidation, zeigen Einatomkatalysatoren vergleichbare oder sogar bessere Leistungen als herkömmliche Nanokatalysatoren.
Ein klassisches Beispiel ist die Kontaktmethode zur Herstellung von Schwefelsäure. 1831 schlug Phillips eine neue Methode zur Herstellung von Schwefelsäure vor, die so genannte Kontaktmethode, bei der Platin als Katalysator verwendet wurde, um die Reaktion von Schwefeldioxid und Sauerstoff zu Schwefeltrioxid zu beschleunigen. Obwohl diese Methode schon früh vorgeschlagen worden war, wurde sie erst 1875 durch die Bemühungen des deutschen Chemikers Maisel industrialisiert. Dieser Fortschritt markierte die erste großtechnische Anwendung von Edelmetallkatalysatoren und verbesserte die Produktivität und Reinheit von Schwefelsäure erheblich. Die Verwirklichung des Kontaktverfahrens verbesserte nicht nur die Effizienz und Qualität der Schwefelsäureproduktion, sondern hatte auch einen tiefgreifenden Einfluss auf die damalige Industrietechnik. Der Prozess konnte nicht vom vollständigen Kontakt zwischen dem Reaktionsmaterial und dem Katalysator getrennt werden, was auch eine gängige Idee für die Realisierung der Mehrphasenkatalyse in späteren industriellen Prozessen war.
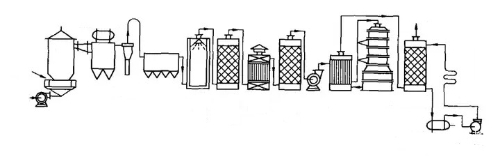
Abb. 4 Prozessablauf der heutigen Kontaktmethode für Schwefelsäure
4.2 Pelletform in Festbettreaktoren
Die Synthese von Vinylacetat durch Gasphasenoxidation von Ethylen wird in einer Festbettreaktoranlage durchgeführt. Bei diesem Verfahren haben Forscher die aktiven Schichten von Edelmetall-Oxidationskatalysatoren systematisch analysiert und die Technik der Partikelheteromorphie sowie deren allgemeine Optimierung für Festbettreaktoren untersucht. Dies deutet darauf hin, dass die Effizienz und Selektivität der Reaktion durch Veränderung der Form und Struktur der Katalysatorteilchen in einem Festbettreaktor verbessert werden kann. Der beladene Pd-Au-Katalysator ist einer der am häufigsten verwendeten Katalysatoren für die Synthese von Vinylacetat durch Gasphasenoxidation von Ethylen. Um die Aktivität der Katalysatoren in der Studie zu bewerten, bauen die Forscher Festbett-Reaktionsvorrichtungen zusammen und untersuchen die Auswirkungen verschiedener Reaktionsbedingungen auf die katalytische Leistung. So hat beispielsweise das Au/Pd-Verhältnis einen erheblichen Einfluss auf die Nullausbeute und die Selektivität des Katalysators. Bei einem Au/Pd-Verhältnis von 0,86 zeigte der Pd-Au/4A-Katalysator eine bessere Leistung. Die geeignete Katalysatorteilchengröße ist ebenfalls eine wichtige Voraussetzung für die oxidative Synthese von Ethylen in der Gasphase in Festbetten. Die für die Ethylen-Gasphasensynthese von Vinylacetat geeigneten Katalysatorträger haben in der Regel eine Partikelgröße von etwa 3-7 mm, wodurch der Katalysator eine gute mechanische Festigkeit und einen geringen Druckabfall aufweist und gleichzeitig die Befüllung und Reaktion im Festbettreaktor erleichtert wird. Es hat sich gezeigt, dass die optimale spezifische Oberfläche von 50-800 m²/g für Katalysatoren mit geeigneter Partikelgröße dazu beiträgt, mehr aktive Stellen bereitzustellen und so die katalytische Wirkung zu verbessern.
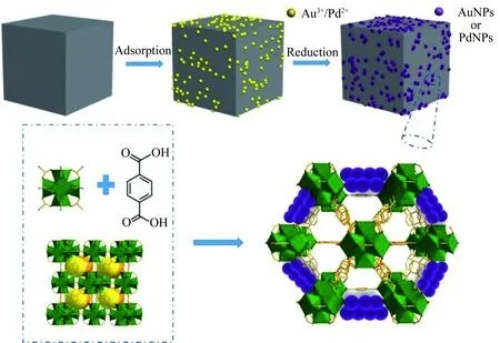
Abb. 5 Schematische Synthesestrategie für beladene Au-Pd-Katalysatoren
4.3 Einfluss der Katalysatorteilchengröße auf die Anwendung
In Kesselreaktoren werden häufig gleichmäßig dispergierte Katalysatoren benötigt, um einen ausreichenden Kontakt zwischen den Reaktanten und dem Katalysator für effiziente Reaktionen zu gewährleisten. Im Hinblick auf die katalytische Effizienz bieten Katalysatoren in Pulverform eine größere Oberfläche und damit mehr aktive Stellen im gleichen Volumen, was die Reaktionseffizienz verbessern kann. Außerdem werden Kesselreaktoren in der Regel für Flüssigphasen- oder Gas-Flüssigphasen-Reaktionen verwendet, und Katalysatoren in Pulverform lassen sich leichter mit Flüssigkeiten oder Gasen mischen, was die Reaktion erleichtert. Aus betrieblicher Sicht wird der Kesselreaktor in der Regel für Batch- oder halbkontinuierliche Prozesse verwendet, bei denen die Vermischung des pulverförmigen Katalysators mit den Reaktanten freier und nicht durch die feste Struktur begrenzt ist. Unter Berücksichtigung der Reaktionsbedingungen kann der pulverförmige Edelmetallkatalysator gleichmäßiger im Reaktionsmedium dispergiert werden, was zu einer besseren Kontrolle der Reaktionstemperatur und der Wärmeverteilung beiträgt und eine lokale Überhitzung verhindert.
In einem Festbettreaktor wird der Katalysator in der Regel auf einem Träger innerhalb des Reaktors immobilisiert, um ein Katalysatorbett zu bilden. Granulatförmige Katalysatoren sind für diese Situation besser geeignet, da sie das Festbett leichter füllen können, die Stabilität und mechanische Festigkeit des Katalysators gewährleisten und gute hydrodynamische Eigenschaften aufweisen. Aus betrieblicher Sicht werden Festbettreaktoren in der Regel für kontinuierliche Prozesse verwendet, und körnige Katalysatoren lassen sich leicht immobilisieren und ermöglichen Stabilität im kontinuierlichen Betrieb. Da der Katalysator in einem Festbettreaktor unbeweglich ist, können die Reaktionsprodukte außerdem direkt aus dem Katalysatorbett fließen, ohne dass zusätzliche Trennschritte erforderlich sind.
In Anbetracht der Reaktionsbedingungen ist der Festbettreaktor für Hochdruckreaktionen geeignet, da die Katalysatorpartikel verdichtet werden können, um die Hohlräume im Reaktor zu verringern und so die Reaktionseffizienz zu verbessern.
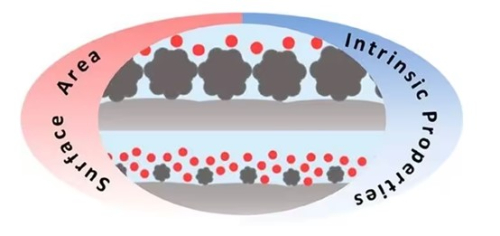
Abb. 6 Schematisches Diagramm des Katalysator-Partikel-Kontakts für verschiedene Partikelgrößen
5 Schlussfolgerung
Edelmetallkatalysatoren zeichnen sich durch hohe Aktivität, Selektivität und thermische Stabilität bei chemischen Reaktionen aus und sind daher von zentraler Bedeutung für chemische Herstellungsprozesse. Ihr Einsatz in der Kessel- und Festbettreaktion zeigt nicht nur ihre breite Anwendbarkeit, sondern unterstreicht auch die Bedeutung der Optimierung der Reaktionsleistung durch Katalysatordesign und Reaktorauswahl. Insbesondere bei chemischen Schlüsselprozessen wie der Synthese von Vinylacetat durch Gasphasenoxidation von Ethylen ist die rationelle Auswahl und Auslegung von Edelmetallkatalysatoren ein Schlüsselfaktor für die Verbesserung der Reaktionseffizienz und Produktqualität. Darüber hinaus wirken sich die Partikelgröße und -form von Edelmetallkatalysatoren direkt auf die Kontakteffizienz und die katalytische Aktivität der Reaktanten aus, so dass Wissenschaftler und Ingenieure diese Parameter genau kontrollieren müssen, um eine optimale Reaktionsleistung zu erzielen. Trotz der vielen Vorteile von Edelmetallkatalysatoren stellen ihre Rückgewinnung und ihr Recycling nach wie vor eine große Herausforderung dar, die nur durch weitere Forschung und technologische Innovation gelöst werden kann. Zusammenfassend lässt sich sagen, dass die Verwendung von Edelmetallkatalysatoren in der modernen chemischen Industrie weiter zunehmen wird und neue Möglichkeiten und Herausforderungen mit sich bringt. Stanford Advanced Materials (SAM) hat sich auf die Bereitstellung einer breiten Palette hochwertiger, hochreiner Edelmetallkatalysatoren spezialisiert, die auf Wunsch auch individuell angepasst werden können. Stöbern Sie in der Produktliste oder nehmen Sie noch heute Kontakt mit uns auf, und einer der SAM-Experten wird Sie beraten.
Verwandte Lesungen:
Edelmetall-Katalysatoren: Ein genauerer Blick auf den Einfluss der Partikelgröße
Häufige Reaktionstypen von homogenen Edelmetallkatalysatoren
Edelmetallkatalysatoren für den Erdölsektor
Vorteile von Edelmetallkatalysatoren
Referenzen:
[1] Gordeeva A N ,Shesterkina A A ,Vikanova V K , et al. Naphthalin und seine Derivate - Hydrierung für die Wasserstoffspeicherung: Vergleichende Analyse der Rolle von Edel- und Nichtedelmetallkatalysatoren - Ein Überblick[J]. International Journal of Hydrogen Energy, 2024, 69.
[2] Qi C X ,Lang F ,Li C , et al. Synergistic Effects of MOFs and Noble Metals in Photocatalytic Reactions: Mechanisms and Applications [J]. ChemPlusChem, 2024.
[3] Fairlie M A . Buchbesprechung: The manufacture of sulfuric acid (contact process)[J]. Industrielle und technische Chemie, 2002, 18(1).
[4] Homme C A ,Othmer F D . Optimierte Bedingungen für die Schwefelsäureherstellung im Kontaktverfahren[J]. Industrie- und Ingenieurchemie, 2002, 53(12).

 Bars
Bars
 Beads & Spheres
Beads & Spheres
 Bolts & Nuts
Bolts & Nuts
 Crucibles
Crucibles
 Discs
Discs
 Fibers & Fabrics
Fibers & Fabrics
 Films
Films
 Flake
Flake
 Foams
Foams
 Foil
Foil
 Granules
Granules
 Honeycombs
Honeycombs
 Ink
Ink
 Laminate
Laminate
 Lumps
Lumps
 Meshes
Meshes
 Metallised Film
Metallised Film
 Plate
Plate
 Powders
Powders
 Rod
Rod
 Sheets
Sheets
 Single Crystals
Single Crystals
 Sputtering Target
Sputtering Target
 Tubes
Tubes
 Washer
Washer
 Wires
Wires
 Converters & Calculators
Converters & Calculators
 Write for Us
Write for Us
 Chin Trento
Chin Trento