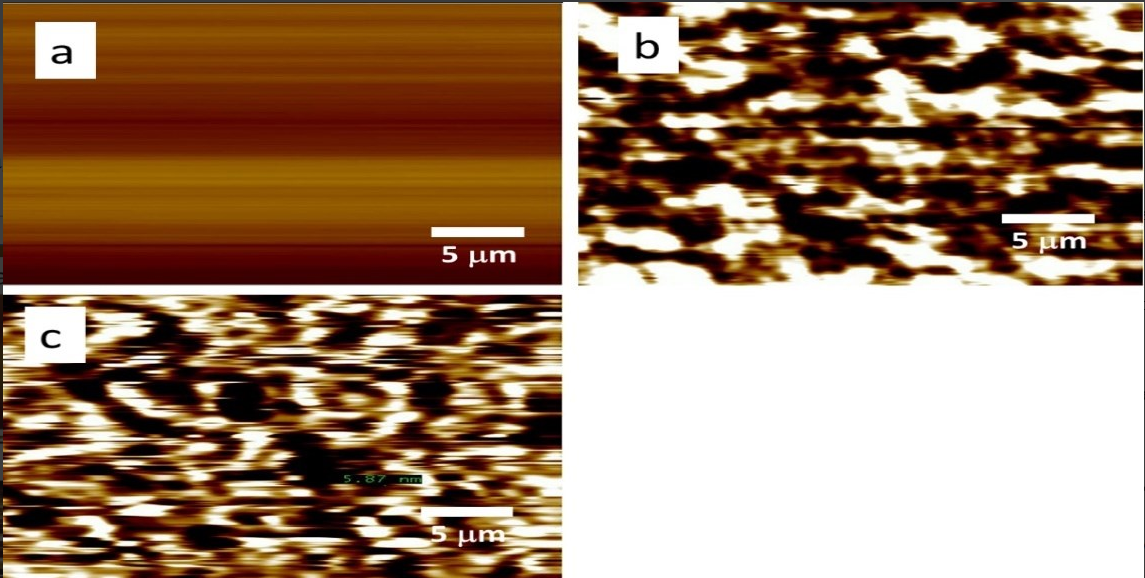
Was sind die Eigenschaften von Beryllium?
Beryllium hat die Ordnungszahl 4, gehört zum zweiten Zyklus der zweiten Hauptgruppe und ist das leichteste Erdalkalimetallelement. Beryllium-Metall ist stahlgrau, der Schmelzpunkt liegt bei 1283 Grad Celsius, der Siedepunkt bei 2570 Grad Celsius, die Dichte bei 1,848 g/cm. Natürliches Beryllium hat drei Isotope: Beryllium 7, Beryllium 8, Beryllium 10, und 9Be ist das einzige stabile Nuklid von Beryllium. Beryllium Erz hat mehr als 30 Arten, Beryllium (3BeO - AlO3 - 6SiO2), Phenakit (2BeO - SiO2), Chrysoberyll (BeO - Al2O3) haben wirtschaftlichen Wert, gibt es die reichsten Ressourcen Beryllium in den Vereinigten Staaten. Als das erste Mitglied der Erdalkalimetalle, die zu den seltenen Leichtmetall, mit geringer Dichte, hoher Schmelzpunkt, hoher Elastizitätsmodul, hohe Zugfestigkeit, hervorragende thermische Eigenschaften, gute Dimensionsstabilität, niedrige Neutronenabsorption Querschnitt, X - Strahlentransmission und andere viele hervorragende Leistungen gehört, ist das unverzichtbare Material in der Luft-und Raumfahrt, Luftfahrt, Elektronik-und Nuklearindustrie, in der Regel als "Super-Metall", "Metall-Spitze".
Eigenschaften von Beryllium
Physikalische Eigenschaften
Beryllium ist ein leichtes, seltenes Metall, dessen atomare Dichte gering ist (nur 1,847 g/cm). Der Schmelzpunkt ist höher (1283 DEG C). Beryllium hat eine dichte Anordnung von sechs Seiten. Der Phasenübergang findet bei 1254 DEG C statt, das ist die Struktur von Beta-Be. Beryllium hat von allen Metallen die größte Wärmekapazität. Bei Raumtemperatur beträgt die spezifische Wärme 1,8828 J/gK, und Beryllium absorbiert mehr Wärme als andere Metalle, und diese Eigenschaft bleibt bis zum Schmelzpunkt erhalten. Die Wärmeleitfähigkeit von Beryllium bei Raumtemperatur beträgt 0,15 kW/(m.K). Der Wärmeausdehnungskoeffizient von Beryllium ist ähnlich wie der von Edelstahl und Ni-Co-Legierungen, und auch die Wärmediffusionsfähigkeit ist gut.
Das Reflexionsvermögen von Beryllium für sichtbares Licht beträgt 50%, das Reflexionsvermögen für ultraviolettes Licht 55% und das Reflexionsvermögen für Infrarotlicht 98%. Die Durchlässigkeit für Röntgenstrahlen ist hoch und ist ein wesentlicher Bestandteil des Röntgenfensters.
Der Elastizitätsmodul von Beryllium ist sehr hoch (309000 MPa), etwa 4 Mal so hoch wie der von Aluminium, 2,5 Mal so hoch wie der von Titan und 1,5 Mal so hoch wie der von Stahl. Die spezifische Steifigkeit beträgt etwa das 6-fache von Stahl, Aluminium und Titan. Darüber hinaus ist die Absorptionsrate thermischer Neutronen bei Beryllium die geringste aller Metalle, während der Streuquerschnitt sehr groß ist.
Darüber hinaus ist Beryllium ein stahlgraues Leichtmetall. Beryllium hat eine höhere Härte als seine Gegenstücke, im Gegensatz zu Calcium, Strontium und Barium, die mit einem Messer geschnitten werden können.

Chemische Eigenschaft
Beryllium ist ein sehr reaktives Metall, das eine große Affinität zu Sauerstoff hat und bei Raumtemperatur mit Sauerstoff reagieren kann, um eine dünne, schützende Oxidschicht auf seiner Oberfläche zu bilden. Bei einer Temperatur von weniger als 600 Grad Celsius kann Beryllium in trockener Luft für eine lange Zeit oxidiert werden, bei mehr als 600 Grad Celsius nimmt die Oxidationsrate allmählich zu. Wenn die Temperatur 800 DEG C erreicht, ist der Oxidationsgrad nicht sehr ernst, wenn es in einer kurzen Zeit bleibt.
Beryllium und Lithium können an der Luft eine schützende Oxidschicht bilden, so dass es auch sehr stabil ist. Es ist unlöslich in kaltem Wasser, leicht löslich in heißem Wasser, löslich in verdünnter Salzsäure, verdünnter Schwefelsäure und Kaliumhydroxidlösung und Wasserstoff. Berylliummetall weist auch bei höheren Temperaturen eine deutliche Korrosionsbeständigkeit gegenüber sauerstofffreiem Metall Natrium auf. Beryllium weist eine positive Valenz auf, was zur Bildung von Polymeren und einer Klasse kovalenter Verbindungen mit hoher thermischer Stabilität führt.
Die anomale Natur von Beryllium
Die Valenzelektronenschichtstruktur des Be-Atoms ist 2S (2), sein Atomradius beträgt 89pm, der Radius des Be-(2+)-Ions 31pm und die Elektronegativität von Be beträgt 1,57. Beryllium aufgrund Atomradius und Ionenradius ist sehr klein, seine Elektronegativität ist relativ hoch, so dass die Tendenz der Beryllium kovalente Bindung ist signifikant, im Gegensatz zu anderen Familie Elemente gebildet hauptsächlich ionische Verbindungen. Daher weist Beryllium oft anomale Eigenschaften auf, die sich von denen anderer Elemente der gleichen Familie unterscheiden.
(1) Beryllium bildet aufgrund seiner Oberfläche leicht einen kompakten Schutzfilm, reagiert aber nicht mit Wasser, während andere Metalle wie Magnesium, Calcium, Strontium und Barium leicht mit Wasser reagieren.
(2) Berylliumhydroxid ist bisexuell, und die Menschen der anderen Elemente sind in starken Alkali oder Hydroxid Alkalität.
(3) Beryllium-Salze werden stark hydrolysiert, um tetraedrische Ionen [Be (H2O) 2]2+ zu bilden, und die Be-O-Bindung ist stark, was die O-H-Bindung schwächt, so dass hydratisierte Beryllium-Ionen eine Tendenz haben, Protonen zu verlieren:
Berylliumsalze sind in reinem Wasser sauer. Die Salze der Elemente derselben Familie (außer Magnesium) hydrolysieren nicht.

 Bars
Bars
 Beads & Spheres
Beads & Spheres
 Bolts & Nuts
Bolts & Nuts
 Crucibles
Crucibles
 Discs
Discs
 Fibers & Fabrics
Fibers & Fabrics
 Films
Films
 Flake
Flake
 Foams
Foams
 Foil
Foil
 Granules
Granules
 Honeycombs
Honeycombs
 Ink
Ink
 Laminate
Laminate
 Lumps
Lumps
 Meshes
Meshes
 Metallised Film
Metallised Film
 Plate
Plate
 Powders
Powders
 Rod
Rod
 Sheets
Sheets
 Single Crystals
Single Crystals
 Sputtering Target
Sputtering Target
 Tubes
Tubes
 Washer
Washer
 Wires
Wires
 Converters & Calculators
Converters & Calculators
 Write for Us
Write for Us
 Chin Trento
Chin Trento