Alles, was Sie über Titaniumoxide wissen müssen
Einführung
Titanoxide sind Verbindungen, die aus Titan und Sauerstoff bestehen und für ihre bemerkenswerten Eigenschaften und vielfältigen Anwendungen bekannt sind. Diese Oxide treten hauptsächlich in zwei Formen auf: Titandioxid (TiO₂) und Titanmonoxid (TiO). Dieser Artikel befasst sich mit den Eigenschaften, Synthesemethoden, Anwendungen und Umweltauswirkungen von Titanoxiden.
Arten von Titanoxiden
1. Titaniumdioxid (TiO₂)
TiO₂ ist ein weißes, geruchloses Pulver mit einem hohen Brechungsindex und starker UV-Lichtabsorption. Es weist eine photokatalytische Aktivität und chemische Stabilität auf und ist ungiftig.
TiO₂ kommt in drei Hauptpolymorphen vor: Anatas, Rutil und Brookit. Anatas und Rutil sind die am häufigsten vorkommenden Polymorphe, wobei Rutil thermodynamisch stabil ist und sich Anatas beim Erhitzen in Rutil verwandelt.

2. Titanmonoxid (TiO)
TiO ist weniger häufig, hat einen metallischen Glanz und ist elektrisch leitfähig. Es hat eine Steinsalzstruktur und wird häufig für spezielle Anwendungen wie dünne Schichten und Beschichtungen verwendet.
Synthese von Titanoxiden
1. Titaniumdioxid (TiO₂)
- Beim Sulfatverfahren zur Herstellung von TiO₂ wird Ilmenit (FeTiO₃) mit Schwefelsäure umgesetzt, wobei Titanylsulfat entsteht. Diese Verbindung wird dann hydrolysiert und kalziniert, um Titandioxid zu erhalten.
- Bei einer anderen Methode, dem so genannten Chloridverfahren, wird Ilmenit oder Rutil bei hohen Temperaturen chloriert, um Titantetrachlorid (TiCl₄) zu bilden, das anschließend oxidiert wird, um TiO₂ zu erzeugen.
- Ein modernerer Ansatz ist das Sol-Gel-Verfahren, bei dem Titanalkoxide einer Hydrolyse und Polymerisation unterzogen werden, gefolgt von Trocknung und Kalzinierung. Dieses Verfahren führt zu TiO₂-Nanopartikeln mit kontrollierter Größe und Morphologie.
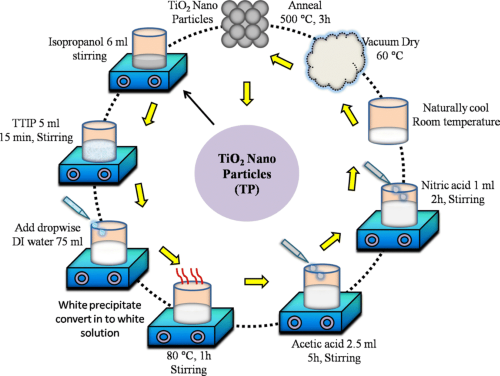 [1]
[1]
2. Titanmonoxid (TiO)
Für die Synthese von Titanmonoxid (TiO) werden in der Regel Reduktionsverfahren eingesetzt. TiO wird in der Regel durch Reduktion von TiO₂ mit Wasserstoff oder durch die direkte Verbindung von Titan und Sauerstoff unter sorgfältig kontrollierten Bedingungen hergestellt.
Anwendungen von Titaniumoxiden
1. Titaniumdioxid (TiO₂)
- Pigmente: TiO₂ ist aufgrund seiner Helligkeit und Opazität das am häufigsten verwendete Weißpigment. Es wird in Farben, Beschichtungen, Kunststoffen, Papier und Druckfarben verwendet.
- Sonnenschutzmittel und Kosmetika: Aufgrund seiner starken UV-Absorption ist TiO₂ ein Hauptbestandteil von Sonnenschutzmitteln und anderen kosmetischen Produkten, die vor schädlicher UV-Strahlung schützen.
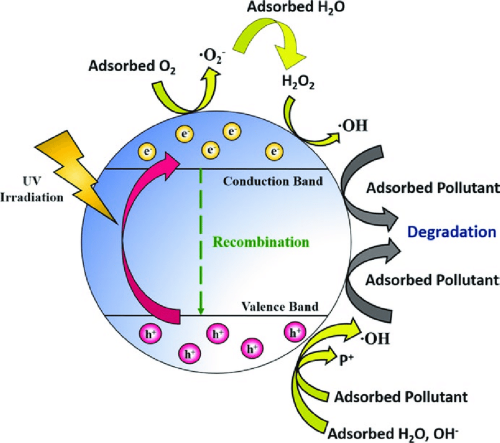
- Photokatalyse: Die photokatalytischen Eigenschaftenvon TiO₂machen es nützlich für Umweltanwendungen wie Luft- und Wasserreinigung, selbstreinigende Oberflächen und antibakterielle Beschichtungen.
- Elektronik: TiO₂ wird aufgrund seiner dielektrischen Eigenschaften bei der Herstellung von elektronischen Bauteilen wie Varistoren und Kondensatoren verwendet.
 [2]
[2]
2. Titanmonoxid (TiO)
Dünne Filme und Beschichtungen: TiO wird zur Herstellung dünner Schichten für Anwendungen in optischen Beschichtungen, Halbleitern und Sensoren verwendet. Seine elektrische Leitfähigkeit und thermische Stabilität machen es für diese Zwecke geeignet.
Umweltauswirkungen und Sicherheit
Umweltauswirkungen: Obwohl TiO₂ im Allgemeinen als unbedenklich für die menschliche Gesundheit und die Umwelt gilt, gibt seine weit verbreitete Verwendung Anlass zur Sorge über die Verschmutzung durch Nanopartikel. TiO₂-Nanopartikel können in Gewässer eindringen und dort möglicherweise das Leben im Wasser beeinträchtigen. Daher gibt es Vorschriften und Richtlinien für die Herstellung und Entsorgung.
Menschliche Gesundheit: TiO₂ gilt als ungiftig, und seine Verwendung in Lebensmitteln, Kosmetika und Arzneimitteln ist geregelt, um die Sicherheit zu gewährleisten. Das Einatmen von TiO₂-Staub kann jedoch ein Risiko für die Atemwege darstellen, was die Bedeutung einer ordnungsgemäßen Handhabung und von Schutzmaßnahmen in industriellen Umgebungen unterstreicht.
Photokatalytische Aktivität: Die photokatalytischen Eigenschaften von TiO₂ können zur Bildung reaktiver Sauerstoffspezies (ROS) führen, die sowohl nützliche als auch schädliche Auswirkungen haben können. In Umweltanwendungen können ROS Schadstoffe abbauen, aber eine übermäßige Exposition gegenüber ROS kann in lebenden Organismen oxidativen Stress verursachen.
Zukunftsperspektiven und Forschung
DieForschung arbeitet an der Entwicklung fortschrittlicher Materialien auf TiO₂-Basis mit verbesserten Eigenschaften für Anwendungen in der Energiespeicherung, Photovoltaik und Photokatalyse. Zu den Innovationen gehören die Dotierung von TiO₂ mit anderen Elementen zur Verbesserung der Effizienz und die Erforschung neuer Synthesemethoden zur besseren Kontrolle von Partikelgröße und Morphologie.
Es werden Anstrengungen unternommen, um nachhaltigere und umweltfreundlichere Methoden zur Herstellung und Nutzung von Titanoxiden zu entwickeln. Dazu gehören die Anwendung der Grundsätze der grünen Chemie, das Recycling von TiO₂-Abfällen und die Verbesserung der Effizienz photokatalytischer Prozesse.
Schlussfolgerung
Titanoxide, insbesondere TiO und TiO₂, spielen in verschiedenen Branchen eine entscheidende Rolle. TiO mit seinem metallischen Glanz und seiner elektrischen Leitfähigkeit wird vor allem in Spezialanwendungen wie dünnen Schichten und Beschichtungen eingesetzt. TiO₂, das für seinen hohen Brechungsindex, seine starke UV-Lichtabsorption, seine photokatalytische Aktivität und seine chemische Stabilität bekannt ist, wird in großem Umfang für Pigmente, Sonnenschutzmittel, Kosmetika, Photokatalyse und Elektronik verwendet.
Im Zuge des technologischen Fortschritts werden Titanoxide auch weiterhin an der Spitze der Materialwissenschaft und der industriellen Anwendungen stehen. Stanford Advanced Materials (SAM) bietet hochwertige Titanprodukte zu wettbewerbsfähigen Preisen. Wir bieten photokatalytisches Nano-Titandioxid-Pulver, Nano-Titandioxid-Pulver für Lithiumbatterien, Nano-Titandioxid-Pulver für Keramik sowie Anatas- und Rutilformen von Titandioxid. Für weitere Informationen besuchen Sie bitte unsere Homepage.
|
Aspekt |
Titanmonoxid (TiO) |
|
|
Eigenschaften |
Weißes, geruchloses Pulver, hoher Brechungsindex, starke UV-Lichtabsorption, photokatalytische Aktivität, chemische Stabilität, ungiftig. |
Metallischer Glanz, elektrische Leitfähigkeit, Steinsalzstruktur. |
|
Synthesemethoden |
Sulfat-Verfahren: Reaktion von Ilmenit (FeTiO₃) mit Schwefelsäure, Hydrolyse und Kalzinierung von Titanylsulfat zur Gewinnung von TiO₂. Chlorid-Verfahren: Chlorierung von Ilmenit oder Rutil zur Bildung von TiCl₄, dann Oxidation zur Herstellung von TiO₂. Sol-Gel-Verfahren: Hydrolyse und Polymerisation von Titanalkoxiden, gefolgt von Trocknung und Kalzinierung zur Gewinnung von TiO₂-Nanopartikeln. |
Reduktionsverfahren: Reduktion vonTiO₂ mit Wasserstoff oder direkter Kombination von Titan und Sauerstoff unter kontrollierten Bedingungen. |
|
Anwendungen |
Pigmente: Farben, Beschichtungen, Kunststoffe, Papier und Druckfarben. Sonnenschutzmittel und Kosmetika: UV-Schutz. Photokatalyse: Luft- und Wasseraufbereitung, selbstreinigende Oberflächen, antibakterielle Beschichtungen. Elektronik: Varistoren, Kondensatoren. |
Dünne Filme und Beschichtungen: Optische Beschichtungen, Halbleiter, Sensoren. |
Referenz:
[1] Pawar, Vani & Kumar, Manish & Dubey, Pawan & Singh, Manish Kumar & Sinha, Ask & Singh, Prabhakar. (2019). Einfluss der Syntheseroute auf die strukturellen, optischen und elektrischen Eigenschaften von TiO2. Applied Physics A. 125. 10.1007/s00339-019-2948-3.
[2] Leong, Kah & Ching, Sim & Pichiah, Saravanan & Ibrahim, S. (2016). Light Driven Nanomaterials for Removal of Agricultural Toxins.

 Bars
Bars
 Perlen & Kugeln
Perlen & Kugeln
 Bolzen & Muttern
Bolzen & Muttern
 Tiegel
Tiegel
 Scheiben
Scheiben
 Fasern & Stoffe
Fasern & Stoffe
 Filme
Filme
 Flocke
Flocke
 Schaumstoffe
Schaumstoffe
 Folie
Folie
 Granulat
Granulat
 Honigwaben
Honigwaben
 Tinte
Tinte
 Laminat
Laminat
 Klumpen
Klumpen
 Maschen
Maschen
 Metallisierte Folie
Metallisierte Folie
 Platte
Platte
 Pulver
Pulver
 Stab
Stab
 Blätter
Blätter
 Einkristalle
Einkristalle
 Sputtering Target
Sputtering Target
 Rohre
Rohre
 Waschmaschine
Waschmaschine
 Drähte
Drähte
 Umrechner & Rechner
Umrechner & Rechner
 Chin Trento
Chin Trento



